تفاعلات أكسدة-اختزال
(بالتحويل من تفاعل أكسدة-اختزال)

الاحتراق – تفاعل أكسدة-اختزال حيث يستخدم فيه الأكسجين كمادة مؤكسدة.
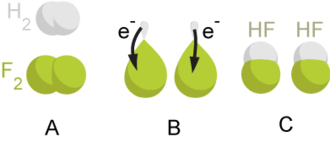
تمثيل لعملية أكسدة-اختزال : تعطي ذرة الهيدروجين إلكترونا لذرة الفلور ، ثم تتحد معه.
تفاعلات أكسدة-اختزال أو الأكسدة-الإرجاع[1] هي جميع التفاعلات الكيميائية التي يحدث فيها تغير في عدد أكسدة ذرات المواد المتفاعلة بسبب انتقال الإلكترونات فيما بينها.
وبتعريف أدق يمكن وصف عملية الأكسدة بالنسبة لعنصر ما (أو لجزيء يحوي عنصر تجري عليه هذه العملية) بأنها زيادة في عدد أكسدة هذا العنصر، في حين أن الاختزال (أو الإرجاع) هو النقصان في عدد الأكسدة.
4 في المواد الغذائية
5 تنفس الخلايا والتمثيل الضوئي
6 تخمير الكحول
7 تحضير الميثان
8 كيمياء كهربية
8.1 الخلية الجلفانية والمركم والكهرل
9 وصلات خارجية
10 اقرأ أيضا
11 المراجع

حيث أن التفاعل الأيوني هو:

حيث أن الحديد يتأكسد (عدد أكسدة الحديد ازداد من 0 إلى +2) :

والنحاس يختزل (عدد أكسدة النحاس تناقص من +2 إلى 0) :

بطارية السيارة هي مثال قريب لتفاعلات أكسدة-اختزال. تتكون بطارية الرصاص في أبسط صورها من لوح رصاص ولوح من أكسيد الرصاص ، يوجد اللوحان في محلول حامض الكبريتيك تعمل البطارية باختزال لوح أكسيد الرصاص وفي نفس الوقت يتأكسد لوح الرصاص. تستمر البطارية تعمل بهذا الشكل حتي " تفرغ" عندما يكون كل الرصاص قد تأكسد وكل أكسيد الرصاص قد اختزل. عندئذ تلزم إعادة شحن البطارية. ونقوم بذلك بتوصيل قطبي البطارية بمصدر كهربائي خارجي ، أي إمدادها بطاقة من الخارج. تعمل تلك الطاقة الكهربائية على عكس التفاعل الذي تم عند تفريغ البطارية ، فيتأكسد لوح الرصاص إلى أكسيد الرصاص كما كان في الأصل ، ويـُختزل لوح أكسيد الرصاص ليصبح رصاصا نقيا كما كان عند شراء البطارية. بعد شحن البطارية يمكن للبطارية أن تقوم بوظيفتها من جديد وتمدنا بالتيار الكهربائي.
 التأكسد: يعطي الفلز M اثنين من الإلكترونات.
التأكسد: يعطي الفلز M اثنين من الإلكترونات.  الاختزال: تكتسب كل ذرة أكسجين إثنين من الإلكترونات.
الاختزال: تكتسب كل ذرة أكسجين إثنين من الإلكترونات.
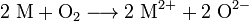 تفاعل أكسدة-اختزال: يؤكسد الأكسجين المعدن ، ويُختزل هو ذاته.
تفاعل أكسدة-اختزال: يؤكسد الأكسجين المعدن ، ويُختزل هو ذاته.
نجد أن الأكسجين يميل إلى اكتساب إلكترونين ليصل إلى غلاف إلكتروني تكافؤي كامل يحتوي على 8 إلكترونات (قاعدة الثمانيات). وأما الفلز فيمكنه عن طريق إعطاء إلكترونين للتخلص من غلاف غير كامل ويصل بذلك إلى التركيب الإلكتروني التالي الأكثر استقرارا.
ونعهد في حياتنا اليومية تأكسد الحديد وينشأ صدأ الحديد. ولصيانة الحديد من الصدأ نعتمد على تفاعلات أكسدة-اختزال.

فرن عالي.
في عملية الفرن العالي يُختزل الحديد بواسطة الفحم الحجري. وينتج خلال هذا التفاعل تفاعلي جانبي ينتج عنه أول أكسيد الكربون وهو مادة مُختزلة جيدة. ولا يتفاعل أول أكسيد الكربون سريعا ويتحول إلى ثاني أكسيد الكربون عند انخفاض وجود أكسجين في الفرن. .[2]
 إمداد الفرن بالحرارة بإحراق الفحم.
إمداد الفرن بالحرارة بإحراق الفحم. 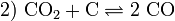 فينتج غاز أول أكسيد الكربون وهو مادة مختزلة جيدة. توازن بودوار
فينتج غاز أول أكسيد الكربون وهو مادة مختزلة جيدة. توازن بودوار  في الخطوة الثالثة : يُختزل أكسيد الحديد بواسطة أول أكسيد الكربون وينتج الحديد النقي .
في الخطوة الثالثة : يُختزل أكسيد الحديد بواسطة أول أكسيد الكربون وينتج الحديد النقي .

تفاعل الثرميت للحام قضبان السكك الحديدية
لتحضير عدد من معادن من أكاسيدها يمكن استخدام الألمونيوم كمادة اختزال ، وذلك عندما يكون المعدن أشد خمولا (نبيل أكثر) من الألمونيوم. في تلك العملية يستخدم الألمونيوم في صورة مسحوق والطريقة تسمى "طريقة الألمونيوم الحرارية".
يخلط أكسيد الحديد مع مسحوق الألمونيوم - وهذا الفاعل يسمى تفاعل الثرميت - ويُشعل فيُختزل أكسيد الحديد وينتج الحديد المنصهر الذي ينصب من بوتقة المخلوط. تستخدم تلك الطريقة للحام قضبان السكك الحديدية ، كما تستخدم في القنابل الحارقة.

 هدرجة حمض دهني غير مشبع بواسطة إضافة الهيدروجين.
هدرجة حمض دهني غير مشبع بواسطة إضافة الهيدروجين.
كذلك تستخدم بعض الأملاح مثل نترات الصوديوم ونترات البوتاسيوم للحفاط على اللحم بتغطيته بتلك الأملاح في عملية تسمى بالإنجليزية curing. يمنع النتريت تكاثر الميكروبات كما يتفاعل مع مايوجلوبين اللحم ويعطيه لونا أحمرا زاهيا Nitrosylmyoglobin ، هذه التفاعلات هي أيضا تفاعلات أكسدة-اختزال: [3]
 إضافة النتريت إلى مايوجلوبين ينتج ميتمايوجلوبين و نتروزيل.
إضافة النتريت إلى مايوجلوبين ينتج ميتمايوجلوبين و نتروزيل.
وتضاف إلى المواد الغذائية الدهنية موادا مضادة للتأكسد لمنع أكسدتها وفسادها ، وتتأكسد مضادات التأكسد بدلا عنها.
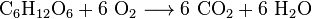
حيث يتفاعل جزيئ جلوكوز مع 6 جزيئات أكسجين وينتج 6 جزيئات ثاني أكسيد الكربون و 6 جزيئات ماء.
ويحدث العكس خلال عملية التمثيل الضوئي حيث تجري في المادة الخضراء للنبات تفاعل ثاني أكسيد الكربون مع الماء في وجود الضوء الذي يمدهما ب طاقة - ويتحولان إلى جلوكوز ويتحرر أكسجين. معادلة التفاعل الكيميائي كالآتي:

ذلك هو التفاعل الأساسي في النبات الذي ينتج الجلوكوز ، ومنه بتفاعلات أخرى يُنتج السكروز والنشا وغيرها.
تستخدم تلك الطريقة في الصناعة على مستوى كبير بغرض إنتاج الطاقة.

وتتم العمليات الكهروكيميائية في الكيمياء الكهربية على أسطح فاصلة بين طورين للمادة. وبناء على ذلك فإن الكيمياء الكهربية هي العلم الذي يدرس العمليات التي تتم بين موصل للإلكترونات (مهبط كمادة في الحالة الصلبة) وبين موصل للأيونات (كهرل).
وتلعب هنا معادلة نرنست دورا أساسيا ، وهي تصف اعتماد جهد القطب على تركيز الكهرل. ويمكن تحليل الكهرل بواسطة تحليل تفاعل أكسدة-اختزال للحصول على تركيز الأيونات في المحلول. ومن الوجهة النظرية فتصف نظرية ماركوس دخول إلكترونات من الخارج في محلول.
تجري تفاعلات الأكسدة والاختزال الكهركيميائية في خلية جلفانية:
(بالتحويل من تفاعل أكسدة-اختزال)

الاحتراق – تفاعل أكسدة-اختزال حيث يستخدم فيه الأكسجين كمادة مؤكسدة.

تمثيل لعملية أكسدة-اختزال : تعطي ذرة الهيدروجين إلكترونا لذرة الفلور ، ثم تتحد معه.
تفاعلات أكسدة-اختزال أو الأكسدة-الإرجاع[1] هي جميع التفاعلات الكيميائية التي يحدث فيها تغير في عدد أكسدة ذرات المواد المتفاعلة بسبب انتقال الإلكترونات فيما بينها.
- الأكسدة هي عملية فقدان للإلكترونات من قبل الذرات أو الجزيئات أو الأيونات ينتج عنها زيادة في الشحنة الموجبة أو نقصان في الشحنة السالبة.
- الاختزال هي عملية اكتساب للإلكترونات من قبل الذرات أو الجزيئات أو الأيونات ينتج عنها نقصان في الشحنة الموجبة أو زيادة في الشحنة السالبة.
وبتعريف أدق يمكن وصف عملية الأكسدة بالنسبة لعنصر ما (أو لجزيء يحوي عنصر تجري عليه هذه العملية) بأنها زيادة في عدد أكسدة هذا العنصر، في حين أن الاختزال (أو الإرجاع) هو النقصان في عدد الأكسدة.
محتويات
- 1 مثال
- 2 بطارية السيارة
- 3 أكسدة فلز
- 3.1 تفاعلات تستخدم في الصناعات
- 3.2 تفاعل الفرن العالي
- 3.3 تفاعل الثرميت
مثال
وكمثال على هذه التفاعلات، التفاعل بين الحديد وكبريتات النحاس الثنائي:
حيث أن التفاعل الأيوني هو:

حيث أن الحديد يتأكسد (عدد أكسدة الحديد ازداد من 0 إلى +2) :

والنحاس يختزل (عدد أكسدة النحاس تناقص من +2 إلى 0) :

بطارية السيارة
 مقالة مفصلة: بطارية الرصاص
مقالة مفصلة: بطارية الرصاص
بطارية السيارة هي مثال قريب لتفاعلات أكسدة-اختزال. تتكون بطارية الرصاص في أبسط صورها من لوح رصاص ولوح من أكسيد الرصاص ، يوجد اللوحان في محلول حامض الكبريتيك تعمل البطارية باختزال لوح أكسيد الرصاص وفي نفس الوقت يتأكسد لوح الرصاص. تستمر البطارية تعمل بهذا الشكل حتي " تفرغ" عندما يكون كل الرصاص قد تأكسد وكل أكسيد الرصاص قد اختزل. عندئذ تلزم إعادة شحن البطارية. ونقوم بذلك بتوصيل قطبي البطارية بمصدر كهربائي خارجي ، أي إمدادها بطاقة من الخارج. تعمل تلك الطاقة الكهربائية على عكس التفاعل الذي تم عند تفريغ البطارية ، فيتأكسد لوح الرصاص إلى أكسيد الرصاص كما كان في الأصل ، ويـُختزل لوح أكسيد الرصاص ليصبح رصاصا نقيا كما كان عند شراء البطارية. بعد شحن البطارية يمكن للبطارية أن تقوم بوظيفتها من جديد وتمدنا بالتيار الكهربائي.
أكسدة فلز
عندما تتفاعل ذرة فلز (معدن) مع ذرة أكسجين يمكن وصف هذا التفاعل بمعادلات التفاعل الآتية: التأكسد: يعطي الفلز M اثنين من الإلكترونات.
التأكسد: يعطي الفلز M اثنين من الإلكترونات.  الاختزال: تكتسب كل ذرة أكسجين إثنين من الإلكترونات.
الاختزال: تكتسب كل ذرة أكسجين إثنين من الإلكترونات.- مجموع هذان التفاعلين يسمى "تفاعل أكسدة-اختزال" ويكتب كالآتي:
 تفاعل أكسدة-اختزال: يؤكسد الأكسجين المعدن ، ويُختزل هو ذاته.
تفاعل أكسدة-اختزال: يؤكسد الأكسجين المعدن ، ويُختزل هو ذاته.نجد أن الأكسجين يميل إلى اكتساب إلكترونين ليصل إلى غلاف إلكتروني تكافؤي كامل يحتوي على 8 إلكترونات (قاعدة الثمانيات). وأما الفلز فيمكنه عن طريق إعطاء إلكترونين للتخلص من غلاف غير كامل ويصل بذلك إلى التركيب الإلكتروني التالي الأكثر استقرارا.
ونعهد في حياتنا اليومية تأكسد الحديد وينشأ صدأ الحديد. ولصيانة الحديد من الصدأ نعتمد على تفاعلات أكسدة-اختزال.
تفاعلات تستخدم في الصناعات
يستخدم حرق وقود احفوري مثل الفحم والنفط والغاز الطبيعي في محطات القوى لإنتاج الطاقة الكهربائية. كذلك تستخدم كثيرا من التفاعلات في التعدين وهي أمثلة تقليدية تبين أهمية تفاعلات أكسدة-اختزال في المجال الصناعي.تفاعل الفرن العالي

فرن عالي.
في عملية الفرن العالي يُختزل الحديد بواسطة الفحم الحجري. وينتج خلال هذا التفاعل تفاعلي جانبي ينتج عنه أول أكسيد الكربون وهو مادة مُختزلة جيدة. ولا يتفاعل أول أكسيد الكربون سريعا ويتحول إلى ثاني أكسيد الكربون عند انخفاض وجود أكسجين في الفرن. .[2]
 إمداد الفرن بالحرارة بإحراق الفحم.
إمداد الفرن بالحرارة بإحراق الفحم.  فينتج غاز أول أكسيد الكربون وهو مادة مختزلة جيدة. توازن بودوار
فينتج غاز أول أكسيد الكربون وهو مادة مختزلة جيدة. توازن بودوار  في الخطوة الثالثة : يُختزل أكسيد الحديد بواسطة أول أكسيد الكربون وينتج الحديد النقي .
في الخطوة الثالثة : يُختزل أكسيد الحديد بواسطة أول أكسيد الكربون وينتج الحديد النقي .تفاعل الثرميت
 مقالة مفصلة: تفاعل الثرميت
مقالة مفصلة: تفاعل الثرميت

تفاعل الثرميت للحام قضبان السكك الحديدية
لتحضير عدد من معادن من أكاسيدها يمكن استخدام الألمونيوم كمادة اختزال ، وذلك عندما يكون المعدن أشد خمولا (نبيل أكثر) من الألمونيوم. في تلك العملية يستخدم الألمونيوم في صورة مسحوق والطريقة تسمى "طريقة الألمونيوم الحرارية".
يخلط أكسيد الحديد مع مسحوق الألمونيوم - وهذا الفاعل يسمى تفاعل الثرميت - ويُشعل فيُختزل أكسيد الحديد وينتج الحديد المنصهر الذي ينصب من بوتقة المخلوط. تستخدم تلك الطريقة للحام قضبان السكك الحديدية ، كما تستخدم في القنابل الحارقة.

في المواد الغذائية
لتحضير السمن الصناعي تستخدم عملية هدرجة محفزة تُجرى على زيوت نباتية. هدرجة حمض دهني غير مشبع بواسطة إضافة الهيدروجين.
هدرجة حمض دهني غير مشبع بواسطة إضافة الهيدروجين.كذلك تستخدم بعض الأملاح مثل نترات الصوديوم ونترات البوتاسيوم للحفاط على اللحم بتغطيته بتلك الأملاح في عملية تسمى بالإنجليزية curing. يمنع النتريت تكاثر الميكروبات كما يتفاعل مع مايوجلوبين اللحم ويعطيه لونا أحمرا زاهيا Nitrosylmyoglobin ، هذه التفاعلات هي أيضا تفاعلات أكسدة-اختزال: [3]
 إضافة النتريت إلى مايوجلوبين ينتج ميتمايوجلوبين و نتروزيل.
إضافة النتريت إلى مايوجلوبين ينتج ميتمايوجلوبين و نتروزيل.وتضاف إلى المواد الغذائية الدهنية موادا مضادة للتأكسد لمنع أكسدتها وفسادها ، وتتأكسد مضادات التأكسد بدلا عنها.
تنفس الخلايا والتمثيل الضوئي
في عملية تنفس الخلايا والتمثيل الغذائي يتحول سكر جلوكوز بالأكسدة إلى ثاني أكسيد الكربون ويُختزل الأكسجين ويتحول إلى ماء. يمكن كتابة معادلة هذا التفاعل الكلية كالآتي:
حيث يتفاعل جزيئ جلوكوز مع 6 جزيئات أكسجين وينتج 6 جزيئات ثاني أكسيد الكربون و 6 جزيئات ماء.
ويحدث العكس خلال عملية التمثيل الضوئي حيث تجري في المادة الخضراء للنبات تفاعل ثاني أكسيد الكربون مع الماء في وجود الضوء الذي يمدهما ب طاقة - ويتحولان إلى جلوكوز ويتحرر أكسجين. معادلة التفاعل الكيميائي كالآتي:

ذلك هو التفاعل الأساسي في النبات الذي ينتج الجلوكوز ، ومنه بتفاعلات أخرى يُنتج السكروز والنشا وغيرها.
تخمير الكحول
تعمل خلايا الخميرة على تخمير محلول سكري وتنتج كحول وثاني أكسيد الكربون :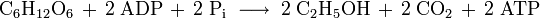
تستخدم تلك الطريقة في الصناعة على مستوى كبير بغرض إنتاج الطاقة.
تحضير الميثان
يوجد نوع من البكتريا يسمى أركابكتريا يمكنها تحضير الميثان من غاز ثاني أكسيد الكربون عن طريق انتزاع الأكسجين:
كيمياء كهربية
الكيمياء الكهربية كأحد فروع الكيمياء الفيزيائية تهتم بدراسة التفاعلات الكيميائية والتفاعلات الكهربية. فعندما ينتج عن تفاعل أكسدة-اختزال تولد تيار كهربائي فيسمى مثل ذلك التفاعل تفاعل كهروكيميائي.وتتم العمليات الكهروكيميائية في الكيمياء الكهربية على أسطح فاصلة بين طورين للمادة. وبناء على ذلك فإن الكيمياء الكهربية هي العلم الذي يدرس العمليات التي تتم بين موصل للإلكترونات (مهبط كمادة في الحالة الصلبة) وبين موصل للأيونات (كهرل).
وتلعب هنا معادلة نرنست دورا أساسيا ، وهي تصف اعتماد جهد القطب على تركيز الكهرل. ويمكن تحليل الكهرل بواسطة تحليل تفاعل أكسدة-اختزال للحصول على تركيز الأيونات في المحلول. ومن الوجهة النظرية فتصف نظرية ماركوس دخول إلكترونات من الخارج في محلول.
الخلية الجلفانية والمركم والكهرل
عندما نُسيير تفاعل أكسدة-اختزال من الخارج عن طريق توصيل جهد كهربائي به ، عندئذ نسمي العملية عملية تحليل كهربائي. أما عندما ينشأ جهد كهربائي عن تفاعل أكسدة-اختزال فنسمي ذلك خلية جلفانية. توصف جهود تفاعل أكسدة-اختزال بواسطة قائمة الجهود القياسية ] . ونعرف من تلك القائمة "شدة" مادة مؤكسدة أو مادة اختزال.تجري تفاعلات الأكسدة والاختزال الكهركيميائية في خلية جلفانية:
- أثناء عملية التحليل الكهربائي وعملية شحن مركم نقوم بإمداد النظام بطاقة كهربائية من الخارج،
- عند تشغيل بطارية أو عند اكتساب تيار كهربائي من خلية وقود نحصل على طاقة كهربائية. وعندما يتم التفاعل كعملية عكوسية بحيث يكون التيار الكهربي مساويا للصفر (I = 0) نحصل بذلك على طاقة جيبس الحرة للتفاعل.
وصلات خارجية
- GCSE التفاعلات
- Chemical Equation Balancer - An open source chemical equation balancer that handles redox reactions.
- Video - Synthesis of Copper(II) Acetate على يوتيوب 20 Feb. 2009
- Redox reactions calculator
- Redox reactions at Chemguide
- Online redox reaction equation balancer, balances equations of any half-cell and full reactions

