تفاعل ناشر للحرارة


رسم توضيحي لتفاعل منتج للحرارة.
في الكيمياء، التفاعل الناشر للحرارة[1] (أو التفاعل الطارد للحرارة أو المنتج للحرارة) هو التفاعل الذي تنطلق منه حرارة . وهو بعكس التفاعل الماص للحرارة الذي لا يتم إلا إمداده بحرارة من الخارج.
مثال على التفاعل الناشر للحرارة ، احتراق الخشب (اتحاد الكربون مع الأكسجين ).
يتم التعبير عن التفاعل المنتج للحرارة بالشكل الآتي:
المتفاعلات ← النواتج + طاقة.
وعند استخدام مسعر يكون التغير في الطاقة الناتجة من التفا عل أكبر كثيرا من حرارة المسعر . وهذا يعنى أن التفاعل يكون منتجا للحرارة عندما يسبب التفاعل زيادة في حرارة الوسط الذي يتم به . مثال على ذلك : نحك عود الكبريت على سطح خشن من أجل إشعاله . ينشأ عن الاحتكاك حرارة بسيطة تعمل على بدء التفاعل بين الكبريت و الأكسجين الذي يشتعل مولدا طاقة حرارية أكبر .
في أي تفاعل ناشر للحرارة تكون الطاقة الابتدائية التي تُمتص لتكسير الروابط أقل من الطاقة الناتجة عن التفاعل ،التي تتولد عند تكون روابط جديدة بين الجزيئات المتفاعلة .
ويصعب للغاية قياس أو حساب كمية الطاقة المطلقة لتفاعل كيميائي ولكن يمكن حساب كل من السخانة (إنثالبي), ΔH, لأى تفاعل كيميائي. ويعتبر مسعر الانفجار وسطا مناسبا لقياس التغير في الطاقة, ΔH, لتفاعل احتراق. وتتناسب قيم ΔH, المحسوبة والمقاسة لطاقة الرابطة كالتالي:
ΔH = الطاقة المستخدمة في تفاعلات كسر الروابط – الطاقة المنطلقة لعمل الروابط في النواتج.
ولأى تفاعل ناشر للحرارة, تكون قيم ΔH سالبة:
2H2(g) + O2(g) → 2 H2O(g
ΔH = −83.6 kJ/mol of O2
يصدر النظام الكيميائي طاقة وينشرها في الوسط المحيط ، وتسمى تلك الحرارة الصادرة منه "إنثالبي التفاعل" . ثم توجد نواتج التفاعل في حالة مستقرة .
ومثال على طاقة التنشيط عندما نشعل عود كبريت من أجل إشعال الخشب ، حيث ينتج احتكاك عود الكبريت بالسطح لخشن تلك الحرارة الأولية المنشطة . أما في الغازات فيجري اشتعالها بشرارة كهربائية.
مثال: يحترق الكربون ويتحد مع اكسجين الهواء مكونا ثاني أكسيد الكربون مع اصدار حرارة.
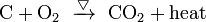 .
.
إنثالبي التفاعل (فرق الإنثالبي) الناتج عن التفاعل سالب الإشارة . ويمكن حسابها من "الإنثالبي العياري للتفاعلات"
سالب الإشارة . ويمكن حسابها من "الإنثالبي العياري للتفاعلات"
إذا كانت طاقة التنشيط قليلة جدا فقد يمكن سريان التفاعل بدون تزويد المخلوط بحرارة من الخارج ، حيث يستمد النظام طاقة التنشيط من جوه المحيط . ويشتعل النظام فوريا (خطورة تخزين المفرقعات) .
فرق الإنثالبي ، ويرمز له هو فرق إنثالبي المواد الناتجة من التفاعل
هو فرق إنثالبي المواد الناتجة من التفاعل 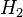 و إنثالبي المواد الداخلة في التفاعل
و إنثالبي المواد الداخلة في التفاعل  , وتكتب المعادلة كالآتي :
, وتكتب المعادلة كالآتي :

ولذلك تكون إشارة الحرارة الناتجة سالبة (المواد المتفاعلة تفقد حرارة ، ويكتسب الإنسان تلك الحرارة . فإذا إضفنا من جهتنا حرارة إلى نظام فإن إشارتها طبعا تكون موجبة ).
وكذلك في الفيزياء : ينتج عن الانشطار النووي طاقة تتحرر ، فالتفاعل الانشطاري عبارة عن تفاعل منتج للحرارة. وتفاعل الاندماج النووي مثل الاندماج النووي للهيدروجين الذي تستمد منه الشمس طاقتها هو أيضا " تفاعل منتج للطاقة".


رسم توضيحي لتفاعل منتج للحرارة.
في الكيمياء، التفاعل الناشر للحرارة[1] (أو التفاعل الطارد للحرارة أو المنتج للحرارة) هو التفاعل الذي تنطلق منه حرارة . وهو بعكس التفاعل الماص للحرارة الذي لا يتم إلا إمداده بحرارة من الخارج.
مثال على التفاعل الناشر للحرارة ، احتراق الخشب (اتحاد الكربون مع الأكسجين ).
يتم التعبير عن التفاعل المنتج للحرارة بالشكل الآتي:
المتفاعلات ← النواتج + طاقة.
وعند استخدام مسعر يكون التغير في الطاقة الناتجة من التفا عل أكبر كثيرا من حرارة المسعر . وهذا يعنى أن التفاعل يكون منتجا للحرارة عندما يسبب التفاعل زيادة في حرارة الوسط الذي يتم به . مثال على ذلك : نحك عود الكبريت على سطح خشن من أجل إشعاله . ينشأ عن الاحتكاك حرارة بسيطة تعمل على بدء التفاعل بين الكبريت و الأكسجين الذي يشتعل مولدا طاقة حرارية أكبر .
في أي تفاعل ناشر للحرارة تكون الطاقة الابتدائية التي تُمتص لتكسير الروابط أقل من الطاقة الناتجة عن التفاعل ،التي تتولد عند تكون روابط جديدة بين الجزيئات المتفاعلة .
ويصعب للغاية قياس أو حساب كمية الطاقة المطلقة لتفاعل كيميائي ولكن يمكن حساب كل من السخانة (إنثالبي), ΔH, لأى تفاعل كيميائي. ويعتبر مسعر الانفجار وسطا مناسبا لقياس التغير في الطاقة, ΔH, لتفاعل احتراق. وتتناسب قيم ΔH, المحسوبة والمقاسة لطاقة الرابطة كالتالي:
ΔH = الطاقة المستخدمة في تفاعلات كسر الروابط – الطاقة المنطلقة لعمل الروابط في النواتج.
ولأى تفاعل ناشر للحرارة, تكون قيم ΔH سالبة:
2H2(g) + O2(g) → 2 H2O(g
ΔH = −83.6 kJ/mol of O2
محتويات
- 1 مسار التفاعل المنتج للحرارة
- 2 فرق الإنثالبي
- 3 أمثلة للتفاعلات الناشرة للحرارة
- 4 وصلات خارجية
- 5 اقرأ أيضا
- 6 المراجع
مسار التفاعل المنتج للحرارة
يكون مخلوط التفاعل عادة في حالة شبه مستقرة (حرجة) . وعن طريق اكتسابها لكمية معينة من الطاقة، تسمى "طاقة التنشيط " أو "إنثالبي التنشيط " يُرفع النظام إلى الحالة الغير مستقرة ويسير التفاعل . وعن طريق التنشيط يبدأ سريان التفاعل ويستمر التفاعل من ذاته بدون الاحتياج إلى تنشيط آخر.يصدر النظام الكيميائي طاقة وينشرها في الوسط المحيط ، وتسمى تلك الحرارة الصادرة منه "إنثالبي التفاعل" . ثم توجد نواتج التفاعل في حالة مستقرة .
ومثال على طاقة التنشيط عندما نشعل عود كبريت من أجل إشعال الخشب ، حيث ينتج احتكاك عود الكبريت بالسطح لخشن تلك الحرارة الأولية المنشطة . أما في الغازات فيجري اشتعالها بشرارة كهربائية.
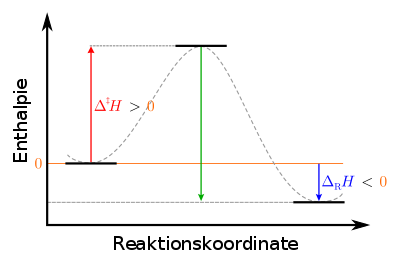 | Legende: 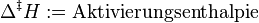  اليسار: حالة المخلوط الأولية (شبه مستقرة): metastable في الوسط: وصول المخلوط إلى الحالة الغير مستقرة : unstable] إلى اليمين: حالة النواتج النهائية : stable] |
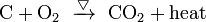 .
.إنثالبي التفاعل (فرق الإنثالبي) الناتج عن التفاعل
 سالب الإشارة . ويمكن حسابها من "الإنثالبي العياري للتفاعلات"
سالب الإشارة . ويمكن حسابها من "الإنثالبي العياري للتفاعلات"إذا كانت طاقة التنشيط قليلة جدا فقد يمكن سريان التفاعل بدون تزويد المخلوط بحرارة من الخارج ، حيث يستمد النظام طاقة التنشيط من جوه المحيط . ويشتعل النظام فوريا (خطورة تخزين المفرقعات) .
فرق الإنثالبي
يعرف الإنثالبي بأنه مجموع الطاقة الداخلية في نظام مضافا إليها حاصل ضرب الضغط في الحجم. وهو ما يحتويه نظام من الطاقة عند ثبات الضغط .فرق الإنثالبي ، ويرمز له
 هو فرق إنثالبي المواد الناتجة من التفاعل
هو فرق إنثالبي المواد الناتجة من التفاعل  و إنثالبي المواد الداخلة في التفاعل
و إنثالبي المواد الداخلة في التفاعل  , وتكتب المعادلة كالآتي :
, وتكتب المعادلة كالآتي :
ولذلك تكون إشارة الحرارة الناتجة سالبة (المواد المتفاعلة تفقد حرارة ، ويكتسب الإنسان تلك الحرارة . فإذا إضفنا من جهتنا حرارة إلى نظام فإن إشارتها طبعا تكون موجبة ).
وكذلك في الفيزياء : ينتج عن الانشطار النووي طاقة تتحرر ، فالتفاعل الانشطاري عبارة عن تفاعل منتج للحرارة. وتفاعل الاندماج النووي مثل الاندماج النووي للهيدروجين الذي تستمد منه الشمس طاقتها هو أيضا " تفاعل منتج للطاقة".
أمثلة للتفاعلات الناشرة للحرارة
- الاحتراق
- التعادل
- تفاعل الثرميت: تفاعل شديد بين الألمونيوم و أكسيد الحديد
- إضافة الماء للأحماض المركزة.

