مول
[list=references]
المول (بالألمانية: Mol): وحدة قياس كمية المادة وتستعمل كثيراً في الكيمياء. إذ أنها وحدة أساسية في النظام الدولي للوحدات[1]، وهي واحدة من الوحدات القليلة المستخدمة لقياس كمية فيزيائية.أتى المصطلح "مول" من الألمانية من كلمة Mol، حيث كان فيلهلم أوستفالد أول من أطلق هذا الاسم في عام 1893[2]، مع أن الوزن المكافئ كان في الاستخدام منذ قرن من الزمان. وقد افترض أن الاسم مشتق من كلمة Molekül أي جزيء.ويعود تاريخ أول استخدام له في الإنكليزية إلى عام 1897 م، حيث ظهرت في أعمال مترجمة من الألمانية[3][4]. وقد استخدمت أيضا مصطلحات مثل "الوزن الجزيئي" أو "وزن الجزيء" كاستخدام مكافئ لكلمة "مول"[1][5]، ولكنها أهملت في وقتنا الحاضر، وبقي مصطلح "المول".محتويات
تعريفيعرف المول بأنه الكتلة الذرية أو الجزيئية للمادة معبراً عنها بالجرام. ويحسب هكذا :
ويعرف المول بأنه كمية المادة التي تحتوي على نفس عدد الجسيمات التي يحتويها 12 جرام من الكربون-12 ، ويرمز له بالإنجليزية mol.
(أي 1 مول هيليوم = 4 جرام)من ذلك يتبين أنه عندما نتكلم عن 1 مول فلا بد من التفرقة عن نوع الجسيمات في المادة ، فإذا كانت ذرات نحسبها بالوزن الذري ، وإذا كانت جزيئات نحسب المول بالوزن الجزيئي الذي يأخذ أعداد الذرات المختلفة في الجزيئ في الحسبان ، ونحسبها دائما بالجرام.
.(انظر تركيز)استنتاجاتالمول كمية المادة في نظام ما يحتوي على عدد من الجسيمات الأولية (مثل الذرات، والجزيئات) مساوي لعدد الذرات الموجودة في 12 جرام من الكربون ، تسمى مول وتحتسب بالجرام.[1]. إذن:
المول وعدد أفوجادروعدد الجسيمات (عدد الذرات أو عدد الجزييئات) التي توجد في 1 مول تساوي عدد أفوجادرو.[7]وهذا يفسر القول بأن 1 مول من الحديد فيه عدد ذرات كما في 1 مول من الكربون.والطريقة الشائعة لقياس كمية مادة ما، هي قياس كتلتها ثم تقسيمها على الكتلة المولية للمادة[8] فنحصل على ما يسمى " ثابت الكتلة المولية " molar mass constant (وقيمة 1 جرام/مول).ويمكن حساب الكتل المولية للمواد المختلفة بسهولة من قيم جدولية للأوزان الذرية وثابت الكتلة المولية. كما توجد طرق أخرى مثل استخدام الحجم المولي أو قياس الشحنة الكهربائية[8].حساب كمية المادةلحساب كمية المادة تستخدم العلاقة الآتية:حيث : كمية المادة , كتلة المادة الكتلة المولية.ونجد الكتل المولية للعناصر الكيميائية في جداول ، كما تمكن حساب الكتلة المولية للمركبات الكيميائية من معرفة تركيبها من العناصر ، واخذ قيم العناصر من الجداول.والكتلة الذرية التي نجدها في الجداول لجميع العناصر محسوبة مع مراعاة نسب النظائر المختلفة للعنصر في تركيبه الطبيعي. فعلى سبيل المثال الكتلة الذرية للكربون تبلغ 12,0107 وحدة كتل ذرية . هذه القيمة مثلا لا نستخدمها في حالة مادة غنية بالكربون-13 (13C).بينما تكون نسب النظائر في العناصر المستقرة الموجودة في الطبيعة تكاد تكون ثابتة ، فلا يصح ذلك بالنسبة للعناصر المشعة حيث تتغير نسب النظائر بشدة بحسب مكان استخراجها وأعمارها.كتلة 1 مول من الماء
كتلة 1 مول هيليوم
تحضير هيدروكسيد الليثيوم من الليثيوم والماءعند تحضير هيدروكسيد الليثيوم LiOH ينقسم جزيئين من الماء بواسطة 2 ذرة ليثيوم إلى 2 H- و 2 OH-. ونظرا لأنه في 1 مول من كل من الماء والليثيوم توجد أعدادا متساوية من الجسيمات ، فإننا نحتاج إلى 2 مول من الليثيوم و 2 مول ماء ، (أو بصفة عامة تكون نسبتهما 2 : 2).ونحسب :2 * 94و6 جرام ليثيوم و 2 * 18 جرام ماء يتفاعلان وينتجان 2 جرام هيدروجين و 88و47 جرام هيدروكسيد الليثيوم.المراجع
[*]المكتب الدولي للموازين والمقاييس (2006)، النظام الدولي للوحدات (الطبعة 8th)، صفحات 114–15، ISBN 92-822-2213-6
[*]^ فيلهلم أوستفالد. Hand- und Hilfsbuch zur ausführung physiko-chemischer Messungen. Leipzig. صفحة 119.
[*]^ Helm، Georg (1897)، The Principles of Mathematical Chemistry: The Energetics of Chemical Phenomena، transl. by Livingston, J.; Morgan, R.، New York: Wiley، صفحة 6
[*]^ Some sources place the date of first usage in English as 1902. Merriam–Webster [5 proposes] an etymology from Molekulärgewicht (molecular weight).
[*]^ de Bièvrae، P.؛ Peiser, H.S. (1992). "'Atomic Weight'—The Name, Its History, Definition, and Units". Pure Appl. Chem. 64 (10): 1535–43. doi:10.1351/pac199264101535.
[*]^ Übersetzt aus http://www.bipm.org/utils/common/pdf/si_brochure_8_en.pdf
[*]^ CODATA Recommended Values. National Institute of Standards and Technology. Retrieved on 16. Juni 2011. Wert für die Avogadro-Konstante
[*]International Bureau of Weights and Measures. "Realising the mole." Retrieved 25 September 2008.
[/list]
[list=references]
المول (بالألمانية: Mol): وحدة قياس كمية المادة وتستعمل كثيراً في الكيمياء. إذ أنها وحدة أساسية في النظام الدولي للوحدات[1]، وهي واحدة من الوحدات القليلة المستخدمة لقياس كمية فيزيائية.أتى المصطلح "مول" من الألمانية من كلمة Mol، حيث كان فيلهلم أوستفالد أول من أطلق هذا الاسم في عام 1893[2]، مع أن الوزن المكافئ كان في الاستخدام منذ قرن من الزمان. وقد افترض أن الاسم مشتق من كلمة Molekül أي جزيء.ويعود تاريخ أول استخدام له في الإنكليزية إلى عام 1897 م، حيث ظهرت في أعمال مترجمة من الألمانية[3][4]. وقد استخدمت أيضا مصطلحات مثل "الوزن الجزيئي" أو "وزن الجزيء" كاستخدام مكافئ لكلمة "مول"[1][5]، ولكنها أهملت في وقتنا الحاضر، وبقي مصطلح "المول".محتويات
- 1 تعريف
- 2 استنتاجات
- 3 المول وعدد أفوجادرو
- 4 حساب كمية المادة
- 5 كتلة 1 مول من الماء
- 6 كتلة 1 مول هيليوم
- 7 تحضير هيدروكسيد الليثيوم من الليثيوم والماء
- 8 المراجع
- 9 اقرأ أيضا
- 10 روابط خارجية
تعريفيعرف المول بأنه الكتلة الذرية أو الجزيئية للمادة معبراً عنها بالجرام. ويحسب هكذا :
- بالنسبة إلى الكربون-12 ووزنه الذري -12. فنقول أن 1 مول من الكربون هو -12 جرام،
ويعرف المول بأنه كمية المادة التي تحتوي على نفس عدد الجسيمات التي يحتويها 12 جرام من الكربون-12 ، ويرمز له بالإنجليزية mol.
- في حالة الكربون والحديد والنحاس تكون الجسيمات عبارة عن ذرات. في أحوال أخرى يمكن أن تكون الجسيمات جزيئات كما هو الحال بالنسبة إلى غاز الأكسجين حيث يتكون جزيئ الأكسجين من ذرتين ، فيكون الوزن الجزيئي 16 + 16 = 32 ، وبذلك يكون 1 مول أكسجين = 32 جرام.
- في حالة الهيدروجين يتكون الجزيئ أيضا من ذرتين من الهيدروجين ، وبما أن وزن ذرة الهيدروجين 1 يكون وزن جزيئ الهيروجين 2 ، ونقول أن الكتلة المولية للهيدروجين = 2 جرام.
- بالنسبة إلى غاز خامل مثل الهيليوم ، فهو يتكون من ذرات منفردة ، فيكون وزنه الذري بالجرام = 1 مول.
(أي 1 مول هيليوم = 4 جرام)من ذلك يتبين أنه عندما نتكلم عن 1 مول فلا بد من التفرقة عن نوع الجسيمات في المادة ، فإذا كانت ذرات نحسبها بالوزن الذري ، وإذا كانت جزيئات نحسب المول بالوزن الجزيئي الذي يأخذ أعداد الذرات المختلفة في الجزيئ في الحسبان ، ونحسبها دائما بالجرام.
- أي من الممكن حساب عدد أيونات في المول [6]
.(انظر تركيز)استنتاجاتالمول كمية المادة في نظام ما يحتوي على عدد من الجسيمات الأولية (مثل الذرات، والجزيئات) مساوي لعدد الذرات الموجودة في 12 جرام من الكربون ، تسمى مول وتحتسب بالجرام.[1]. إذن:
- يحتوي مول واحد من الحديد على عدد مساوي من الذرات الموجودة في مول واحد من الذهب.
- يحتوي مول واحد من البنزين على عدد مساوي من الجزيئات الموجودة في مول واحد من الماء.
- كما أن عدد الذرات الموجودة في مول واحد من الحديد مساوي لعدد الجزيئات في مول واحد من الماء.
المول وعدد أفوجادروعدد الجسيمات (عدد الذرات أو عدد الجزييئات) التي توجد في 1 مول تساوي عدد أفوجادرو.[7]وهذا يفسر القول بأن 1 مول من الحديد فيه عدد ذرات كما في 1 مول من الكربون.والطريقة الشائعة لقياس كمية مادة ما، هي قياس كتلتها ثم تقسيمها على الكتلة المولية للمادة[8] فنحصل على ما يسمى " ثابت الكتلة المولية " molar mass constant (وقيمة 1 جرام/مول).ويمكن حساب الكتل المولية للمواد المختلفة بسهولة من قيم جدولية للأوزان الذرية وثابت الكتلة المولية. كما توجد طرق أخرى مثل استخدام الحجم المولي أو قياس الشحنة الكهربائية[8].حساب كمية المادةلحساب كمية المادة تستخدم العلاقة الآتية:حيث : كمية المادة , كتلة المادة الكتلة المولية.ونجد الكتل المولية للعناصر الكيميائية في جداول ، كما تمكن حساب الكتلة المولية للمركبات الكيميائية من معرفة تركيبها من العناصر ، واخذ قيم العناصر من الجداول.والكتلة الذرية التي نجدها في الجداول لجميع العناصر محسوبة مع مراعاة نسب النظائر المختلفة للعنصر في تركيبه الطبيعي. فعلى سبيل المثال الكتلة الذرية للكربون تبلغ 12,0107 وحدة كتل ذرية . هذه القيمة مثلا لا نستخدمها في حالة مادة غنية بالكربون-13 (13C).بينما تكون نسب النظائر في العناصر المستقرة الموجودة في الطبيعة تكاد تكون ثابتة ، فلا يصح ذلك بالنسبة للعناصر المشعة حيث تتغير نسب النظائر بشدة بحسب مكان استخراجها وأعمارها.كتلة 1 مول من الماء
- يحتوي 1 مول من المادة على :
- 1 6,022·1023 من الجسيمات.
- 1 جزيء ماء
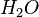 يتكون من 1 ذرة أكسجين + 2 ذرة هيدروجين.
يتكون من 1 ذرة أكسجين + 2 ذرة هيدروجين. - تحتوي ذرة الأكسجين على 16 نوكليون (نيوترونات وبروتونات) ، وتحتوي ذرة الهيدروجين على 1 بروتون.
- أي يحتوي جزيء الماء على 18 نوكليون
- كتلة النيوكليون 1,6605 · 10−24 جرام.
- كتلة 1 جزيء ماء تبلغ 18 · 1,6605 · 10 −24 جرام.
- كتلة 1 مول ماء هو 6,022·1023 ضعفا لكتلة الهيدروجين.
كتلة 1 مول هيليوم
- ذرة الهيليوم لها كتلة تعادل 4 وحدة كتل ذرية (2 بروتون و 2 نيوترون ،(ونهمل الإلكترونات حيث أنها أخف كثيرا جدا). وغاز الهيليوم أحادي الذرة حيث لا تدخل ذرته في ارتباط مع عنصر آخر ولا مع ذرة أخرى من الهيليوم.
- 1 مول هيليوم له كتلة 4 جرام ويحتوي على نحو 6,022·1023 من ذرات الهيليوم.
تحضير هيدروكسيد الليثيوم من الليثيوم والماءعند تحضير هيدروكسيد الليثيوم LiOH ينقسم جزيئين من الماء بواسطة 2 ذرة ليثيوم إلى 2 H- و 2 OH-. ونظرا لأنه في 1 مول من كل من الماء والليثيوم توجد أعدادا متساوية من الجسيمات ، فإننا نحتاج إلى 2 مول من الليثيوم و 2 مول ماء ، (أو بصفة عامة تكون نسبتهما 2 : 2).ونحسب :2 * 94و6 جرام ليثيوم و 2 * 18 جرام ماء يتفاعلان وينتجان 2 جرام هيدروجين و 88و47 جرام هيدروكسيد الليثيوم.المراجع
[*]المكتب الدولي للموازين والمقاييس (2006)، النظام الدولي للوحدات (الطبعة 8th)، صفحات 114–15، ISBN 92-822-2213-6
[*]^ فيلهلم أوستفالد. Hand- und Hilfsbuch zur ausführung physiko-chemischer Messungen. Leipzig. صفحة 119.
[*]^ Helm، Georg (1897)، The Principles of Mathematical Chemistry: The Energetics of Chemical Phenomena، transl. by Livingston, J.; Morgan, R.، New York: Wiley، صفحة 6
[*]^ Some sources place the date of first usage in English as 1902. Merriam–Webster [5 proposes] an etymology from Molekulärgewicht (molecular weight).
[*]^ de Bièvrae، P.؛ Peiser, H.S. (1992). "'Atomic Weight'—The Name, Its History, Definition, and Units". Pure Appl. Chem. 64 (10): 1535–43. doi:10.1351/pac199264101535.
[*]^ Übersetzt aus http://www.bipm.org/utils/common/pdf/si_brochure_8_en.pdf
[*]^ CODATA Recommended Values. National Institute of Standards and Technology. Retrieved on 16. Juni 2011. Wert für die Avogadro-Konstante
[*]International Bureau of Weights and Measures. "Realising the mole." Retrieved 25 September 2008.
[/list]

