توازن ديناميكي
(بالتحويل من توازن دينامي)
يحدث التوازن الديناميكي في الكيمياء عندما تثبت نسبة المواد المتفاعلة إلى المواد الناتجة في تفاعل عكوس، ويصبح التفاعل في حالة مستقرة. وفي الترموديناميكيكا يكون نظام مغلق في حالة توازن ترموديناميكي عندما تحدث تفاعلات بمعدلات لا تتغير فيها نسبة المواد مع الزمن. وفي الواقع تحدث تفاعلات بطيئة جداً في النظام بحيث لا نستطيع رؤيتها. ويمكننا التعبير عن ثوابت التوازن بواسطة ثوابت معدلات سريان التفاعلات.
عندئذ قد يغادر جزيء CO2 السائل ولكن في نفس الوقت يغادر جزيء آخر من ثاني أكسيد الكربون الغاز إلى السائل. وعند «معدل التوازن» تكون معدل مغادرة جزيئات ثاني أكسيد الكربون مساوياً لمعدل رجوع جزيئات ثاني أكسيد الكربون من الحالة الغازية إلى الحالة السائلة.
ويعطي قانون هنري تركيز التوازن لثاني أكسيد الكربون، والذي يقول أن ذوبان غاز في سائل يتناسب تناسباً طردياً مع الضغط الجزئي لهذا الغاز فوق السائل. [1] ونكتب تلك العلاقة كالآتي:
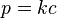
حيث:
k ثابت يعتمد على درجة الحرارة, p الضغط الجزئي، c تركيز الغاز في السائل.
أي أن الضغط الجزئي لثاني أكسيد الكربون في الغاز يزداد طبقاً لقانون هنري. في نفس الوقت يقل تركيز ثاني أكسيد الكربون في السائل، ولذلك نلاحظ تغيراً في طعم الكوكاكولا الباقية.
ويمكن أن يحدث التوازن الديناميكي في نظام متجانس ونجد تلك الحالة في حالة توازن حامض وقاعدة مثلما في حالة انشقاق حمض الأسيتيك في محلول من الماء.
CH3CO2H CH3CO2- + H+
CH3CO2- + H+
نجد في حالة التوازن أن نسبة التركيزات K_c – وهو ثابت تفكك الحامض – يكون ثابتا (تحت ظروف معينة):

أي أن ثابت توازن التفاعل يساوي حاصل ضرب تركيز البروتونات المنشقة في تركيز الجزيئات المنشقة مقسوماً على تركيز الجزيئات غير المنشقة.
يتضمن التفاعل في اتجاه اليمين تحرير بعضاً من البروتونات من جزيئات حمض الأسيتيك ، أما في الاتجاه العكسي فيسير التفاعل بتكوين جزيئات حمض الأسيتيك عن طريق اكتساب أيونات حمض الأسيتيك لبروتونات. ونصل إلى حالة التوازن الديناميكي عندما يكون مجموع الكمونات الكيميائية للمكونات على يسار التفاعل مساوياً لمجموع الكمونات الكيميائية على يمين التفاعل.
في حالة التوازن الديناميكي تلك يكون معدل التفاعل من اليسار إلى اليمين مساوياً لمعدل التفاعل من اليمين إلى اليسار. كما ينطبق ذلك على توازن تفاعلات تكوين المركبات، وفيها تتحكم ثوابت استقرار المعقدات (بالإنجليزية) في نسب التركيز.

وهنا يجري تفإعلان: حيث يتزامر المركب A إلى المركب B في اتجاه اليسار ، ويتزامر (يغير شكله) B فيغير شكلi إلى A. فيمكننا حساب معدل التفاعل:[2]

حيث:
kf ثابت معدل التفاعل للتفاعل نحو اليمينkb ثابت المعدل للتفاعل نحو اليسار، حيث تعني الأقواس المستقيمة [..] التركيزات.
فإذا افترضنا وجود A في البدء عند الزمن t=0, وكان تركيزه A]0], يكون مجموع التركيزين A]t] و B]t], عند الزمن t, مساوياً A]0].

وبحل تلك المعادلة التفاضلية نحصل على:
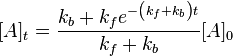
وهو يعطينا التركيز ] عند الزمن t، كدالة لثوابت المعدلات.
] عند الزمن t، كدالة لثوابت المعدلات.
ومع مرور الزمن يقترب كل من التركيزين A]t] و B]t] من مقدارين ثابتين. فإذا صبرنا حتى وقت طويل نسميه ∞→t , فنحصل على:

وعملياً يصبح التغير في التركيزات غير محسوس بعد زمن .
.
ونظراً لعدم حدوث تغير في التركيزات بعد ذلك الوقت يسمى ذلك حالة "توازن التركيزات". ويمكننا الآن تعريف ثابت التوازن للتفاعل بأنه:

نستنتج من ذلك أن ثابت التوازن هو نسبة ثابتي المعدلين:

وبصفة عامة يمكن أن تكون تفاعلات أكثر من فاعل واحد في اتجاه اليمين، وأكثر من تفاعل واحد في اتجاه اليسار. ويذكر العالم الكيميائي أتكنس [2] أنه بالنسبة إلى تفاعل ما يكون ثابت التوازن العام معتمداً على ثوابت المعدلات للتفاعلات البسيطة، وذلك طبقاً للعلاقة:
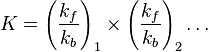
[*]^ Atkins, Section 5.3
[/list]
Atkins, Section 22.4
(بالتحويل من توازن دينامي)
يحدث التوازن الديناميكي في الكيمياء عندما تثبت نسبة المواد المتفاعلة إلى المواد الناتجة في تفاعل عكوس، ويصبح التفاعل في حالة مستقرة. وفي الترموديناميكيكا يكون نظام مغلق في حالة توازن ترموديناميكي عندما تحدث تفاعلات بمعدلات لا تتغير فيها نسبة المواد مع الزمن. وفي الواقع تحدث تفاعلات بطيئة جداً في النظام بحيث لا نستطيع رؤيتها. ويمكننا التعبير عن ثوابت التوازن بواسطة ثوابت معدلات سريان التفاعلات.
محتويات
- 1 أمثلة
- 2 توازن محلول حمض الأسيتيك
- 3 العلاقة بين التوازن وثوابت معدلات التفاعل
- 4 المراجع
- 5 اقرأ أيضاً
أمثلة
ولنتخذ مثال زجاجة الكوكاكولا فهي تحتوي على مقدار معلوم من ثاني أكسيد الكربون في حالة سائلة. وعندما نفتح الزجاجة ونصب منها النصف ثم نغلقها ثانياً، نلاحظ أن بعضاً من ثاني أكسيد الكربون السائل في الزجاجة يتحول إلى الحالة الغازية حتى يصل الضغط الجزئي لثاني أكسيد الكربون إلى حالة التوازن.عندئذ قد يغادر جزيء CO2 السائل ولكن في نفس الوقت يغادر جزيء آخر من ثاني أكسيد الكربون الغاز إلى السائل. وعند «معدل التوازن» تكون معدل مغادرة جزيئات ثاني أكسيد الكربون مساوياً لمعدل رجوع جزيئات ثاني أكسيد الكربون من الحالة الغازية إلى الحالة السائلة.
ويعطي قانون هنري تركيز التوازن لثاني أكسيد الكربون، والذي يقول أن ذوبان غاز في سائل يتناسب تناسباً طردياً مع الضغط الجزئي لهذا الغاز فوق السائل. [1] ونكتب تلك العلاقة كالآتي:
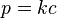
حيث:
k ثابت يعتمد على درجة الحرارة, p الضغط الجزئي، c تركيز الغاز في السائل.
أي أن الضغط الجزئي لثاني أكسيد الكربون في الغاز يزداد طبقاً لقانون هنري. في نفس الوقت يقل تركيز ثاني أكسيد الكربون في السائل، ولذلك نلاحظ تغيراً في طعم الكوكاكولا الباقية.
توازن محلول حمض الأسيتيك
يمكننا صياغة قانون هنري عن طريق جعل الجهد الكيميائي لثاني أكسيد الكربون في كل من السائل والغاز متساوياً. فعن طريق تساوي الجهد الكيميائي يحدث التوازن الكيميائي. كما يتطلب التوازن الديناميكي في حالة تغير طور المادة معاملات تقسيم وناتج الذوبان. ويعرف قانون راؤول حالة توازن ضغط البخار لسائل مثالي.ويمكن أن يحدث التوازن الديناميكي في نظام متجانس ونجد تلك الحالة في حالة توازن حامض وقاعدة مثلما في حالة انشقاق حمض الأسيتيك في محلول من الماء.
CH3CO2H
 CH3CO2- + H+
CH3CO2- + H+نجد في حالة التوازن أن نسبة التركيزات K_c – وهو ثابت تفكك الحامض – يكون ثابتا (تحت ظروف معينة):

أي أن ثابت توازن التفاعل يساوي حاصل ضرب تركيز البروتونات المنشقة في تركيز الجزيئات المنشقة مقسوماً على تركيز الجزيئات غير المنشقة.
يتضمن التفاعل في اتجاه اليمين تحرير بعضاً من البروتونات من جزيئات حمض الأسيتيك ، أما في الاتجاه العكسي فيسير التفاعل بتكوين جزيئات حمض الأسيتيك عن طريق اكتساب أيونات حمض الأسيتيك لبروتونات. ونصل إلى حالة التوازن الديناميكي عندما يكون مجموع الكمونات الكيميائية للمكونات على يسار التفاعل مساوياً لمجموع الكمونات الكيميائية على يمين التفاعل.
في حالة التوازن الديناميكي تلك يكون معدل التفاعل من اليسار إلى اليمين مساوياً لمعدل التفاعل من اليمين إلى اليسار. كما ينطبق ذلك على توازن تفاعلات تكوين المركبات، وفيها تتحكم ثوابت استقرار المعقدات (بالإنجليزية) في نسب التركيز.
العلاقة بين التوازن وثوابت معدلات التفاعل
نفترض تفاعل التزامر الكيميائي:
وهنا يجري تفإعلان: حيث يتزامر المركب A إلى المركب B في اتجاه اليسار ، ويتزامر (يغير شكله) B فيغير شكلi إلى A. فيمكننا حساب معدل التفاعل:[2]

حيث:
kf ثابت معدل التفاعل للتفاعل نحو اليمينkb ثابت المعدل للتفاعل نحو اليسار، حيث تعني الأقواس المستقيمة [..] التركيزات.
فإذا افترضنا وجود A في البدء عند الزمن t=0, وكان تركيزه A]0], يكون مجموع التركيزين A]t] و B]t], عند الزمن t, مساوياً A]0].

وبحل تلك المعادلة التفاضلية نحصل على:
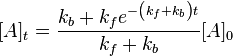
وهو يعطينا التركيز
 ] عند الزمن t، كدالة لثوابت المعدلات.
] عند الزمن t، كدالة لثوابت المعدلات.ومع مرور الزمن يقترب كل من التركيزين A]t] و B]t] من مقدارين ثابتين. فإذا صبرنا حتى وقت طويل نسميه ∞→t , فنحصل على:

وعملياً يصبح التغير في التركيزات غير محسوس بعد زمن
 .
.ونظراً لعدم حدوث تغير في التركيزات بعد ذلك الوقت يسمى ذلك حالة "توازن التركيزات". ويمكننا الآن تعريف ثابت التوازن للتفاعل بأنه:

نستنتج من ذلك أن ثابت التوازن هو نسبة ثابتي المعدلين:

وبصفة عامة يمكن أن تكون تفاعلات أكثر من فاعل واحد في اتجاه اليمين، وأكثر من تفاعل واحد في اتجاه اليسار. ويذكر العالم الكيميائي أتكنس [2] أنه بالنسبة إلى تفاعل ما يكون ثابت التوازن العام معتمداً على ثوابت المعدلات للتفاعلات البسيطة، وذلك طبقاً للعلاقة:
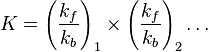
المراجع
[list=references][*]^ Atkins, Section 5.3
[/list]
Atkins, Section 22.4

