درجة التفاعل
تعرف درجة التفاعل في الكيمياء (بالإنجليزية:order of reaction ) تعرف بأنها مجموع الأسات الذي ترفع بمقدارها تركيز المواد الداخلة في التفاعل ، وقد أدخلت تلك الأسات بغرض تعيين معادلة المعدل. [1]. تعين قيمة أس تركيز كل مادة من التجارب المعلمية في حالة التفاعلات المعقدة . أما في حالة تفاعل أولي فيمكن حساب تلك القوى حسابيا بواسطة تعيين حساب العناصر المتفاعلة .
2A + B → C
حيث يتحد 2 جزيئ من المركب A مع 1 جزيئ من المركب B فينتجا المركب C ، فتعطينا الديناميكا الحرارية معادلة معدل التفاعل كالآتي:
r = k[A]21
وتكون درجة التفاعل بالنسبة للمادة A هي 2 وتكون بالنسبة إلى المادة B هي 1 ، وتكون درجة التفاعل الكلية مساوية 1 = 3. ولا يلزم لأن تكون درجة التفاعل عددا صحيحا ، فيمكن أن تساوي صفرا أو عددا أقل من 1 ، ولكنها تميل لأن تكون أعدادا صحيحة في أغلب الأحوال . ويمكن تعيين درجة التفاعل من التجربة فقط ، واستنباطها يتطلب معرفة خط سير التفاعل .
وليس من الضروري أن تمثل الأسات في معادلة المعدل حساب العناصر المتفاعلة ما عدا في حالة التفاعل الأولي فيكونوا متساويين . أما في حالة التفاعلات المعقدة فقد لا يكون لها درجة تفاعل مساوية لمعاملات حساب العناصر المتفاعلة .
CH3COOC2H5 + OH− → CH3COO− + C2H5OH.
ويمكن وصفه بمعادلة معدل التفاعل r:
[r = k[CH3COOC2H5][OH
[ r = k[imidazole][CH3COOC2H5
وذلك على الرغم من عدم وجود إميدازول (وهو عامل مساعد) في حساب العناصر المتفاعلة .
ArN2+ + X− → ArX + N2
تكون معادلة معدل التفاعل :
[r = k[ArN2+

فهل يعني ذلك حقيقة أن جزيئين من المادة A تتصادم مع جزيئ واحد من B وجزيئ C وجزيئ D في نفس الوقت لكي تنتج المادة E ؟
في الواقع مثل هذا الحدث وهو تصادم خمسة جزيئات مع بعضهما في نفس اللحظة من الأحداث النادرة جدا ، وعلاوة على ذلك فلا بد و أن يصتدموا بالطاقة اللازمة لإتمام التفاعل.
واحتمال تصادم جزيئين أو ثلاثة جزيئات فينتج عنه "ناتج وسطي " يكون أكبر بكثير من احتمال تصادم أربعة أو خمسة جزيئات. وعندما تتصادم جزيئات وسطية مع جزيئات أخرى تنشأ "جزيئات وسطية "أخرى ويستمر ذلك حتى يتكون الناتج E . أي يمكن أن يتم التفاعل على مراحل بالشكل التالي:
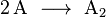

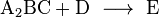
وهذا معناه تقسيم التفاعل الكامل على خطوات من "تفاعلات أولية " ، ودراستها تفسر لنا كيفية سير التفاعل .
ويمكن عن طريق التجربة تعيين كيف تتغير سرعة كل تفاعل أولي بتغير تركيز كل من المواد A و B و C و D .
ويسمى اعتماد سرعة التفاعل على الأس الذي ترفع إليه تركيز أحد المواد المتفاعلة "درجة التفاعل" لتلك المادة .
وتكون درجة التفاعل الكلي هي مجموع درجات التفاعل للمواد المشتركة في التفاعل .
مثـــال
نعتبر أن سرعة التفاعل الأولي الأول أعلاه تعتمد على مربع تركيز المادة A فنجد أنه من الدرجة الثانية بالنسبة للمادة A. ونظرا لعدم اشتراك مادة أخرى في هذا التفاعل تكون درجة هذا التفاعل من الدرجة الثانية.
ولننظر إلى سرعة التفاعل الثاني أعلاه ونجد أنها معتمدة خطيا على تركيز A2 وكذلك خطيا على تركيز B ولا تعتمد على تركيز C . فيكون التفاعل من الدرجة الأولى بالنسبة إلى A2, ومن الدرجة الأولى بالنسبة إلى B و من الدرجة صفر بالنسبة إلى تركيز C. فتكون الدرجة الكلية لهذا التفاعل من الدرجة الثانية .
وبافتراض أن سرعة التفاعل الثالث تعتمد خطيا مع تركيز المادة A2BC, ولا تعتمد عل تركيز D ، فيكون تفاعل من الدرجة الأولى بالنسبة إلى A2BC ومن الدرجة صفر بالنسبة إلى المادة D .
فتكون الدرجة الكلية للتفاعل من الدرجة الأولى.

حيث:
v – سرعة التفاعل ( – تركيز المادة A عند النقطة الزمنية t t – الزمن k – ثابت معدل التفاعل
– تركيز المادة A عند النقطة الزمنية t t – الزمن k – ثابت معدل التفاعل
أمثلة لتلك التفاعلات نجدها في التفاعلات الكيميائية الضوئية وفي التفاعلات المحفزة.
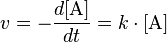
وإذا قمنا بتكامل المعادلة نحصل على:
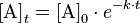
وفيها :
A]t] – تركيز المادة A عند النقطة الزمنية t، A]0] – التركيز الابتدائي A .

وفي حالة اعتماد سرعة التفاعل على تركيز إحدى المادتين :

وبالتكامل نحصل على تركيز المادة A عند الزمن t:

حيث:
[A] –تركيز المادة A ، – تركيز المادة B .
وعند اختلاف المادتين المتفاعلتين A و B ( وغالبا ما يكون ذلك في التفاعلات الكيميائية ) واختلاف تركيز كل منهما فنجد عند تكامل معادلة السرعة : [3]:
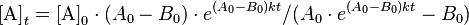
حيث:
A0 - تركيز المادة A عند الزمن t=0 ،B0 - تركيز المادة B عند الزمن t=0 .
وتتبع معظم التفاعلات بين مادتين الجارية في محاليل أو في حالة صلبة بتلك الطريقة .
ونجد منها حالات خاصة يكون أحد المادتين المتفاعلتين ذات تركيز عالي جدا بحيث يجعل تغير التركيز مع الزمن خلال سير التفاعل قليل جدا . ونجد مثل ذلك التفاعل مثلا عندما يجري التفاعل في الماء ويكون الماء في تلك الحالة أحد المادتين المتفاعلتين وفي نفس الوقت المذيب للمادة الثانية ، مثلما في التحليل الكهربائي للإستر . في تلك الحالة تتبع سرعة التفاعل نفس سلوك تفاعل من الدرجة الأولى. ونظرا لكون هذا التفاعل على الرغم من ذلك تفاعل بين مادتين فيسمى هذا النوع من التفاعلات "شبه تفاعل من الدرجة الأولى".
كما نجد حالة خاصة أخرى عندما نعين درجة تفاعل عمليا ونجده تفاعل من الدرجة صفر (بالرغم من حدوث تفاعل درجته أعلى من ذلك) ، فيسمى ذلك التفاعل "شبه تفاعل من الدرجة صفر". ونجد ذلك النوع في التفاعلات المحفزة مثل تحفيز الإنزيمات أو تحفيز الإيثان لاكتساب هيدروكسيل .
سرعة التفاعل لثلاثة مواد :
بالنسبة إلى التفاعل الأولي يمكن كتابة معادلة سرعة التفاعل :
يمكن كتابة معادلة سرعة التفاعل :

ونلاحظ هنا أن المعامل 1/2 يأتي من حساب العناصر المتفاعلة وليس من التفاعل الأولي (بينما كان من المفروض أن نعتبر الأس 3 من التفاعل الأولي).
وليس من التفاعل الأولي (بينما كان من المفروض أن نعتبر الأس 3 من التفاعل الأولي).
الصيغة التكاملية هي :

ومن أمثلة تلك التفاعلات نجد التفاعل : .
.
[*]^ IUPAC's Goldbook definition of order of reaction
[*]^ Kenneth A. Connors Chemical Kinetics, the study of reaction rates in solution, 1990, VCH Publishers
[*]^ Lothar Papula,Enke Verlag (1977), Übungen und Anwendung zur Mathematik für Chemiker, Seite 382-385
[/list]
تعرف درجة التفاعل في الكيمياء (بالإنجليزية:order of reaction ) تعرف بأنها مجموع الأسات الذي ترفع بمقدارها تركيز المواد الداخلة في التفاعل ، وقد أدخلت تلك الأسات بغرض تعيين معادلة المعدل. [1]. تعين قيمة أس تركيز كل مادة من التجارب المعلمية في حالة التفاعلات المعقدة . أما في حالة تفاعل أولي فيمكن حساب تلك القوى حسابيا بواسطة تعيين حساب العناصر المتفاعلة .
محتويات
- 1 مقدمــــة
- 2 تفسير
- 3 تفاعل من الدرجة صفر
- 4 تفاعل من الدرجة الأولى
- 5 تفاعل من الدرجة الثانية
- 6 تفاعل من الدرجة الثالثة
- 7 المراجع
- 8 اقرأ أيضا
مقدمــــة
على سبيل المثال إذا كان لدينا التفاعل الكيميائي:2A + B → C
حيث يتحد 2 جزيئ من المركب A مع 1 جزيئ من المركب B فينتجا المركب C ، فتعطينا الديناميكا الحرارية معادلة معدل التفاعل كالآتي:
r = k[A]21
وتكون درجة التفاعل بالنسبة للمادة A هي 2 وتكون بالنسبة إلى المادة B هي 1 ، وتكون درجة التفاعل الكلية مساوية 1 = 3. ولا يلزم لأن تكون درجة التفاعل عددا صحيحا ، فيمكن أن تساوي صفرا أو عددا أقل من 1 ، ولكنها تميل لأن تكون أعدادا صحيحة في أغلب الأحوال . ويمكن تعيين درجة التفاعل من التجربة فقط ، واستنباطها يتطلب معرفة خط سير التفاعل .
وليس من الضروري أن تمثل الأسات في معادلة المعدل حساب العناصر المتفاعلة ما عدا في حالة التفاعل الأولي فيكونوا متساويين . أما في حالة التفاعلات المعقدة فقد لا يكون لها درجة تفاعل مساوية لمعاملات حساب العناصر المتفاعلة .
- وعلى سبيل المثال فإن عملية اتحاد إيثيل الأسيتات لأيون الهيدروكسيد فهو تفاعل معقد :[2]:
CH3COOC2H5 + OH− → CH3COO− + C2H5OH.
ويمكن وصفه بمعادلة معدل التفاعل r:
[r = k[CH3COOC2H5][OH
- ومعدل تفاعل إيثيل الأسيتات في وجود العامل المساعد إميدازول :
[ r = k[imidazole][CH3COOC2H5
وذلك على الرغم من عدم وجود إميدازول (وهو عامل مساعد) في حساب العناصر المتفاعلة .
- وفي حالة تفاعل أيونات أريل ديازونيوم مع محب للنواة في محلول مائي :
ArN2+ + X− → ArX + N2
تكون معادلة معدل التفاعل :
[r = k[ArN2+
تفسير
تصف معادلة التفاعل عدد جزيئات المواد الداخلة في التفاعل وعدد الجزيئات المتكونة من التفاعل (حساب العناصر المتفاعلة). ولنأخذ التفاعل الآتي علي سبيل المثال:
فهل يعني ذلك حقيقة أن جزيئين من المادة A تتصادم مع جزيئ واحد من B وجزيئ C وجزيئ D في نفس الوقت لكي تنتج المادة E ؟
في الواقع مثل هذا الحدث وهو تصادم خمسة جزيئات مع بعضهما في نفس اللحظة من الأحداث النادرة جدا ، وعلاوة على ذلك فلا بد و أن يصتدموا بالطاقة اللازمة لإتمام التفاعل.
واحتمال تصادم جزيئين أو ثلاثة جزيئات فينتج عنه "ناتج وسطي " يكون أكبر بكثير من احتمال تصادم أربعة أو خمسة جزيئات. وعندما تتصادم جزيئات وسطية مع جزيئات أخرى تنشأ "جزيئات وسطية "أخرى ويستمر ذلك حتى يتكون الناتج E . أي يمكن أن يتم التفاعل على مراحل بالشكل التالي:
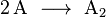

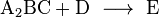
وهذا معناه تقسيم التفاعل الكامل على خطوات من "تفاعلات أولية " ، ودراستها تفسر لنا كيفية سير التفاعل .
ويمكن عن طريق التجربة تعيين كيف تتغير سرعة كل تفاعل أولي بتغير تركيز كل من المواد A و B و C و D .
ويسمى اعتماد سرعة التفاعل على الأس الذي ترفع إليه تركيز أحد المواد المتفاعلة "درجة التفاعل" لتلك المادة .
وتكون درجة التفاعل الكلي هي مجموع درجات التفاعل للمواد المشتركة في التفاعل .
مثـــال
نعتبر أن سرعة التفاعل الأولي الأول أعلاه تعتمد على مربع تركيز المادة A فنجد أنه من الدرجة الثانية بالنسبة للمادة A. ونظرا لعدم اشتراك مادة أخرى في هذا التفاعل تكون درجة هذا التفاعل من الدرجة الثانية.
ولننظر إلى سرعة التفاعل الثاني أعلاه ونجد أنها معتمدة خطيا على تركيز A2 وكذلك خطيا على تركيز B ولا تعتمد على تركيز C . فيكون التفاعل من الدرجة الأولى بالنسبة إلى A2, ومن الدرجة الأولى بالنسبة إلى B و من الدرجة صفر بالنسبة إلى تركيز C. فتكون الدرجة الكلية لهذا التفاعل من الدرجة الثانية .
وبافتراض أن سرعة التفاعل الثالث تعتمد خطيا مع تركيز المادة A2BC, ولا تعتمد عل تركيز D ، فيكون تفاعل من الدرجة الأولى بالنسبة إلى A2BC ومن الدرجة صفر بالنسبة إلى المادة D .
فتكون الدرجة الكلية للتفاعل من الدرجة الأولى.
تفاعل من الدرجة صفر
لا تعتمد تلك التفاعلات على تركيز المواد المتفاعلة ، وتكون سرعة التفاعل ثابتة . ويحدث ذلك على سبيل المثال في التفاعلات التي تعتمد على امتصاص الضوء أو مساحة العامل الحافز كما في بعض التفاعلات السطحية غير المتجانسة
حيث:
v – سرعة التفاعل (
 – تركيز المادة A عند النقطة الزمنية t t – الزمن k – ثابت معدل التفاعل
– تركيز المادة A عند النقطة الزمنية t t – الزمن k – ثابت معدل التفاعلأمثلة لتلك التفاعلات نجدها في التفاعلات الكيميائية الضوئية وفي التفاعلات المحفزة.
تفاعل من الدرجة الأولى
نجد تلك تلك التفاعلات في التفاعلات المحفزة عند استخدام عامل مساعد وفي عمليات . التحلل الإشعاعي . وتعتمد سرعة التفاعل هنا على تركيز العنصر المتحلل فقط.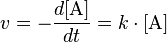
وإذا قمنا بتكامل المعادلة نحصل على:
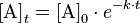
وفيها :
A]t] – تركيز المادة A عند النقطة الزمنية t، A]0] – التركيز الابتدائي A .
تفاعل من الدرجة الثانية
في تلك التفاعلات تتفاعل مادتين لتكوين مركب أو أكثر . وفيها تعتمد سرعة التفاعل على تركيزي المادتين المتفاعلتين :
وفي حالة اعتماد سرعة التفاعل على تركيز إحدى المادتين :

وبالتكامل نحصل على تركيز المادة A عند الزمن t:

حيث:
[A] –تركيز المادة A ، – تركيز المادة B .
وعند اختلاف المادتين المتفاعلتين A و B ( وغالبا ما يكون ذلك في التفاعلات الكيميائية ) واختلاف تركيز كل منهما فنجد عند تكامل معادلة السرعة : [3]:
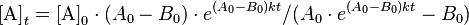
حيث:
A0 - تركيز المادة A عند الزمن t=0 ،B0 - تركيز المادة B عند الزمن t=0 .
وتتبع معظم التفاعلات بين مادتين الجارية في محاليل أو في حالة صلبة بتلك الطريقة .
ونجد منها حالات خاصة يكون أحد المادتين المتفاعلتين ذات تركيز عالي جدا بحيث يجعل تغير التركيز مع الزمن خلال سير التفاعل قليل جدا . ونجد مثل ذلك التفاعل مثلا عندما يجري التفاعل في الماء ويكون الماء في تلك الحالة أحد المادتين المتفاعلتين وفي نفس الوقت المذيب للمادة الثانية ، مثلما في التحليل الكهربائي للإستر . في تلك الحالة تتبع سرعة التفاعل نفس سلوك تفاعل من الدرجة الأولى. ونظرا لكون هذا التفاعل على الرغم من ذلك تفاعل بين مادتين فيسمى هذا النوع من التفاعلات "شبه تفاعل من الدرجة الأولى".
كما نجد حالة خاصة أخرى عندما نعين درجة تفاعل عمليا ونجده تفاعل من الدرجة صفر (بالرغم من حدوث تفاعل درجته أعلى من ذلك) ، فيسمى ذلك التفاعل "شبه تفاعل من الدرجة صفر". ونجد ذلك النوع في التفاعلات المحفزة مثل تحفيز الإنزيمات أو تحفيز الإيثان لاكتساب هيدروكسيل .
تفاعل من الدرجة الثالثة
في تلك التفاعلات تتفاعل ثلاثة مواد لإنتاج مركب أو أكثر. ويندر هذا النوع من التفاعلات ، (ومن الوجهة الإحصائية يكون احتمال تصادم بين ثلاثة جزيئات في نفس اللحطة وبالطاقة الكافية نادرا جدا) . في تلك الحالات نجد تفاعل لمادتين يبدأ العملية ثم يتلوها تفاعل مع المادة الثلاثة فتنتج المركب الناتج . ونذكر هنا على سبيل المثال تفاعل الثلاثة جزيئات في تفاعل إعادة الارتباط .سرعة التفاعل لثلاثة مواد :
بالنسبة إلى التفاعل الأولي
 يمكن كتابة معادلة سرعة التفاعل :
يمكن كتابة معادلة سرعة التفاعل :
ونلاحظ هنا أن المعامل 1/2 يأتي من حساب العناصر المتفاعلة
 وليس من التفاعل الأولي (بينما كان من المفروض أن نعتبر الأس 3 من التفاعل الأولي).
وليس من التفاعل الأولي (بينما كان من المفروض أن نعتبر الأس 3 من التفاعل الأولي).الصيغة التكاملية هي :

ومن أمثلة تلك التفاعلات نجد التفاعل :
 .
.المراجع
[list=references][*]^ IUPAC's Goldbook definition of order of reaction
[*]^ Kenneth A. Connors Chemical Kinetics, the study of reaction rates in solution, 1990, VCH Publishers
[*]^ Lothar Papula,Enke Verlag (1977), Übungen und Anwendung zur Mathematik für Chemiker, Seite 382-385
[/list]

