معدل التفاعل

صدأ الحديد - تفاعل كيميائي سرعته بطيئة.

احتراق الخشب - تفاعل كيميائي يجري بسرعة كبيرة.
معدل التفاعل أو معدل سرعة التفاعل الكيميائي (بالإنجليزية: Reaction rate) هو معدل التغير في كميات (تركيز) المواد المتفاعلة أو الناتجة في وحدة الزمن.[1] أو معدل تغير نواتج التفاعل في وحدة الزمن.أي أنه عبارة عن زيادة تركيز المواد الناتجة بمرور الزمن. وبأخذ قانون بقاء المادة في الاعتبار فإن زيادة تركيز النواتج يعني نقص تركيز المواد الداخلة في التفاعل.
نفترض التفاعل :

هذا التفاعل يدل على تفاعل a مول من المادة A مع b مول من المادة B لإنتاج c مول من المادة C و d مول من المادة D.
وتكون سرعة التفاعل المذكور :

باعتبار و
و تمثلان تركيزي المادتين المتفاعلتين
تمثلان تركيزي المادتين المتفاعلتين  و
و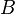 ، وفي نفس الوقت تمثل
، وفي نفس الوقت تمثل  و
و  تركيزي المادتين الناتجتين
تركيزي المادتين الناتجتين 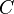 و
و . إذا فإن سرعة التفاعل الكميائي يعتمد بشكل مباشر على تركيز المواد الابتدائية فالعلاقة طردية بينهما ، كما تلعب درجة الحرارة دورا رئيسيا.
. إذا فإن سرعة التفاعل الكميائي يعتمد بشكل مباشر على تركيز المواد الابتدائية فالعلاقة طردية بينهما ، كما تلعب درجة الحرارة دورا رئيسيا.
وعلى سبيل المثال يتفاعل الميثان مع الكلور في الظلام ولكن التفاعل يكون بطيئا جدا. ولكن في وجود ضوء خافت يتفاعل الغازان. ويصل التفاعل درجة الانفجار عند تعرض المخلوط إلى ضوء شديد.
وعلى سبيل المثال يسرع البلاتين احتراق الهيدروجين بالأكسجين عند درجة الحرارة العادية.
تؤخذ جميع المؤثرات على معدل التفاعل في معادلة المعدل في الحسبان ، ماعدا التركيز ودرجة التفاعل (أنظر أسفله).
نكتب معادلة المعدل للتفاعل الكيميائي :
n A + m B → C + D
كالآتي طبقا لتعريف الترموديناميكا الحرارية والذي يربط سرعة التفاعل بتركيز المواد الداخلة في التفاعل ، في الصيغة :

في تلك المعادلة تمثل (k(T ثابت معدل التفاعل أو "ثابت التفاعل" مع أنه ليس ثابتا حقيقيا بسبب احتوائه على عوامل كثيرة تؤثر على سرعة التفاعل ماعدا تركيز المواد ، والتي لا بد من أخذها في الحسبان ومن ضمنها كما نرى اعتماده على درجة الحرارة T. وتعتبر درجة الحرارة أهم تلك المؤثرات.
و الأسين في المعادلة n وm
وm يسميان درجة التفاعل وهما يعتمدان على طريقة سير التفاعل ، وتستنبط مقاديرهما عمليا من التجربة. وبالنسبة لتفاعل أولي فيتفق الأسين n
يسميان درجة التفاعل وهما يعتمدان على طريقة سير التفاعل ، وتستنبط مقاديرهما عمليا من التجربة. وبالنسبة لتفاعل أولي فيتفق الأسين n وm
وm المرفوعة لقوتهما تركيز المواد مع معاملات حساب العناصر المتفاعلة. حساب العناصر المتفاعلة ، أي عدد جزيئات كل مادة من المواد الداخلة في التفاعل لإنتاج جزيئ واحد من الناتج أو الجزيئين C و D ، بالإضافة إلى درجة التفاعل لا بد من اعتبارهما بالنسبة للتفاعل البسيط. والتفاعل البسيط هو ذلك التفاعل الذي يتم على خطوة واحدة. وتصف معادلة التفاعل التفاعل البسيط كعملية على مستوى الذرة ، أي يصتدم عدد n من الجزيئات A مع عدد m من الجزيئات B فينتج عدد من الجزيئات D.
المرفوعة لقوتهما تركيز المواد مع معاملات حساب العناصر المتفاعلة. حساب العناصر المتفاعلة ، أي عدد جزيئات كل مادة من المواد الداخلة في التفاعل لإنتاج جزيئ واحد من الناتج أو الجزيئين C و D ، بالإضافة إلى درجة التفاعل لا بد من اعتبارهما بالنسبة للتفاعل البسيط. والتفاعل البسيط هو ذلك التفاعل الذي يتم على خطوة واحدة. وتصف معادلة التفاعل التفاعل البسيط كعملية على مستوى الذرة ، أي يصتدم عدد n من الجزيئات A مع عدد m من الجزيئات B فينتج عدد من الجزيئات D.
وبالنسبة لتفاعلات الغازات فيمكن الاستعاضة عن التركيز (الذي يستخدم في السوائل أو المواد الصلبة) ب الضغط اجزئي طبقا لقانون الغاز المثالي.
وبربط قانون المعدل مع توازن الكتلة للنظام المتفاعل ، فيمكن استنتاج صيغة لمعدل تغير التركيز. فإذا اعتبرنا نظام مغلق حجمه ثابت فتكون الصيغة لتغير التركيز C كالآتي:

بزيادة درجة الحرارة فإن متوسط الطاقة الحركية للجسيمات (جزيئات أو أيونات أو ذرات) تزداد، فيزداد بالتالي عدد الجسيمات التي تمتلك طاقة التنشيط، فتزداد فرص التصادم، فتزداد سرعة التفاعل.
تعطي معادلة أرينيوس اعتماد معامل سرعة التفاعل k على درجة الحرارة:
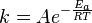
تعني Ea طاقة التنشيط:
و R ثابت الغازات العام.
ونطرا لأن درجة الحرارة T تحدد طاقة الجزيئات طبقا لتوزيع بولتزمان فيمكن القول بأن عدد التصادمات ذات طاقة أكبر من Ea تتناسب طرديا مع . أي أن ارتفاع درجة الحرارة تعمل علي اكتساب مجموعة أكبر من الجزيئات لطاقة قدرها Ea وبالتالي يتقترب الدالة الأسية من 1.
. أي أن ارتفاع درجة الحرارة تعمل علي اكتساب مجموعة أكبر من الجزيئات لطاقة قدرها Ea وبالتالي يتقترب الدالة الأسية من 1.
ويعني A معامل الدالة الأسية ويسمى في الكيمياء معامل تردد التصادم.
وتعتمد قيم كل من A وEa على التفاعل.
ويرتبط اعتماد ثابت معدل التفاعل على الضغط بما يسمى حجم التنشيط. ويسير التفاعل بأن تكوّن المواد المتفاعلة "مركبا وسطيا" وعادة يكون هذا المركب الوسطي في حالة إثارة. وبعدها يفقد المركب الوسطي الطاقة الزائدة ويفقد إثارته وينتج المركب الناتج من التفاعل.
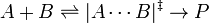
يبلغ حجم التنشيط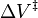 ,:
,:

حيث :
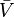 الحجم المولي الجزئي لكل من المواد المتفاعلة والناتجة من التفاعل ، d
الحجم المولي الجزئي لكل من المواد المتفاعلة والناتجة من التفاعل ، d  حالة الإثارة للمركب الوسطي.
حالة الإثارة للمركب الوسطي.
وينتج أن تغير ثابت معدل التفاعل (المعتمد على المولية النسبية أو التركيز المولي) بتغير الضغط عند درجة حرارة ثابتة :

وقد يكون الحال أكثر تعقيدا حيث أن الحجم المولي الجزئي وحجم التنشيط قد يعتمدان بدورهما على الضغط.
وقد يزداد معدل التفاعل أو ينحفض بالضغط وهذا يعتمد على قيمة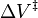 . ونعطي هنا مثالا على تاثير الضغط حيث تزيد سرعة التفاعل إلى الضعف عند تغير الضغط من الضغط الجوي (1و0 ميجا باسكال) إلى 50 ميجا باسكال لبعض تفاعلات المواد العضوية (وهذا يتميز بقيمة
. ونعطي هنا مثالا على تاثير الضغط حيث تزيد سرعة التفاعل إلى الضعف عند تغير الضغط من الضغط الجوي (1و0 ميجا باسكال) إلى 50 ميجا باسكال لبعض تفاعلات المواد العضوية (وهذا يتميز بقيمة 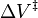 =-0.025 لتر/مول).[3]
=-0.025 لتر/مول).[3]

يكون معدل التفاعل :

ونلاحظ أن معدل التفاعل لا يمثل ببسلطة معاملات حساب العناصر المتفاعلة لجميع مواد التفاعل : فنجد أنه من الدرجة الأولى بالنسبة إلى H2, مع أن معامل حساب العناصر المتفاعلة 2 ، وعهو من الدرجة الثانية بالنسبة إلى NO.
وطبقا للحركة الحرارية الكيميائية chemical kinetics فهي تقسم التفاعل الكيميائي إلى عدة تفاعلات أولية بسيطة ، تنتج في نهايتها نواتج التفاعل. ولا تؤثر جميع تلك التفاعلات الأولية على سرعة التفاعل وإنما كما هو متوقع يحدد التفاعل الأولي الأكثر بطئا السرعة النهائية للتفاعل. فعلى سبيل المثال بالنسبة إلى التفاعل:
نجد أن التفاعل 1 والتفاعل 3 يتميزان بسرعات تفاعل عالية بالمقارنة بسرعة التفاعل 2 ، فهو التفاعل الأقل سرعة بينهم. وبناء على ذلك فخطوته البطيئة هل التي تحدد سرعة التفاعل. وتعين درجة التفاعل سرعة التفاعل.
[*]^ الكيمياء للصف الثالث الثانوي - الفصل الدراسي الأول - التعليم السعودي
[*]^ Kenneth Connors, Chemical Kinetics, 1990, VCH Publishers, pg. 14
[*]^ Isaacs, N.S., "Physical Organic Chemistry, 2nd edition, Section 2.8.3, Adison Wesley Longman, Harlow UK, 1995
[/list]

صدأ الحديد - تفاعل كيميائي سرعته بطيئة.

احتراق الخشب - تفاعل كيميائي يجري بسرعة كبيرة.
معدل التفاعل أو معدل سرعة التفاعل الكيميائي (بالإنجليزية: Reaction rate) هو معدل التغير في كميات (تركيز) المواد المتفاعلة أو الناتجة في وحدة الزمن.[1] أو معدل تغير نواتج التفاعل في وحدة الزمن.أي أنه عبارة عن زيادة تركيز المواد الناتجة بمرور الزمن. وبأخذ قانون بقاء المادة في الاعتبار فإن زيادة تركيز النواتج يعني نقص تركيز المواد الداخلة في التفاعل.
محتويات
- 1 عوامل مؤثرة على سرعة التفاعلات
- 2 مؤثرات على سرعة التفاعل
- 3 معادلة معدل التفاعل
- 4 اعتماد سرعة التفاعل على درجة الحرارة
- 5 اعتماد سرعة التفاعل على الضغط
- 6 امثلة تفاعلات
- 7 المصادر
- 8 اقرأ أيضا
عوامل مؤثرة على سرعة التفاعلات
- طبيعة المواد المتفاعلة (أيونات, جزيئات , ذرات).
- تركيز المواد المتفاعلة ،
- المواد الحافزة،
- درجة الحرارة ، حيث كلما زادت درجة الحرارة زادت سرعة التفاعل ،
- الضغط، كلما زاد الضغط كلما زادت سرعة التفاعل.
نفترض التفاعل :

هذا التفاعل يدل على تفاعل a مول من المادة A مع b مول من المادة B لإنتاج c مول من المادة C و d مول من المادة D.
وتكون سرعة التفاعل المذكور :

باعتبار
 و
و تمثلان تركيزي المادتين المتفاعلتين
تمثلان تركيزي المادتين المتفاعلتين  و
و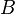 ، وفي نفس الوقت تمثل
، وفي نفس الوقت تمثل  و
و  تركيزي المادتين الناتجتين
تركيزي المادتين الناتجتين 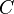 و
و . إذا فإن سرعة التفاعل الكميائي يعتمد بشكل مباشر على تركيز المواد الابتدائية فالعلاقة طردية بينهما ، كما تلعب درجة الحرارة دورا رئيسيا.
. إذا فإن سرعة التفاعل الكميائي يعتمد بشكل مباشر على تركيز المواد الابتدائية فالعلاقة طردية بينهما ، كما تلعب درجة الحرارة دورا رئيسيا.مؤثرات على سرعة التفاعل
- طبيعة المواد المتفاعلة : بعض التفاعلات تجري سريعا ، وهذا يعتمد على عدد المواد الداخلة في التفاعل وطورها إن كانت صلبة أو سائلة أو في حالة غازية حيث تتحرك المواد الصلبة بسرعة أقل من حركة الجزيئات في الحالة الغازية.
- التركيز: تزداد سرعة التفاعل بزيادة التركيز طبقا لقانون المعدل ويفسره نظرية التصادم. فبزيادة تركيز المواد المتفاعلة يزداد معدل تصادم الجزيئات بعضها البعض.
- الضغط : يزداد معدل تفاعل الغازات مع زيادة الضغط ، الذي ما هو إلا زيادة في تركيز الغاز. أما في حالة تفاعل المواد الصلبة أو السائلة فمعدل تفاعلها يعتمد ضعيفا على الضغط.
- درجة التفاعل: تحدد درجة التفاعل اعتماد معدل التفاعل على تركيز المواد المتفاعلة أو ضغطها.
- درجة الحرارة: إجراء التفاعل عند درجة حرارة أعلى تمد النظام المتفاعل بطاقة حرارية من الخارج مما يزيد من معدل التفاعل ، بسبب زيادة معدل الاصتدامات بين الجزيئات المتفاعلة ، وهذا ما تقوله نظرية التصادم. ولكن السبب الأساسي وراء هذه الزيادة في معدل التفاعل هو أن ارتفاع درجة الحرارة يعمل على زيادة الجزيئات ذات طاقة تنشيط مما يؤدي إلى اصتدامات "ناجحة" (تجعل الجزيئات تتحد مع بعضها البعض). وتصف معادلة أرينيوس سلوك النظام المتفاعل بارتفاع درجة الحرارة. كما تصف قاعدة Q10 قاعدة تقريبية بأنه لكثير من التفاعلات يتضاعف معدل التفاعل لكل ارتفاع في درجة الحرارة قدره 10 درجات مئوية.[2]
- المذيبات: تجري بعض التفاعلات في محاليل وقد تؤثر طبيعة السائل المذيب معدل سريان التفاعل.
- الإشعاع الكهرومغناطيسي ، والضوء الشديد : الأشعة الكهرومغناطيسية هي أحد أنواع الطاقة. ولهذا فيمكنها تسريع معدل التفاعل. وقد تتسبب في انفصال الروابط بين الذرات في الجزيئات ، أو إثارة الجزيئات ، فتنشأ مركبات وسطية تساعدنا على الحصول على الناتج المطلوب. (أما بالنسبة إلى الأدوية فقد تُفسد تلك التفاعلات الغير مرغوبة الدواء ، لذلك ينصح بالحفاظ على الأدوية في مكان مظلم أو في ثلاجة. وأحيانا تعبأ الأدوية السائلة الحساسة للضوء في زجاجات بنية اللون ماصة للضوء.)
وعلى سبيل المثال يتفاعل الميثان مع الكلور في الظلام ولكن التفاعل يكون بطيئا جدا. ولكن في وجود ضوء خافت يتفاعل الغازان. ويصل التفاعل درجة الانفجار عند تعرض المخلوط إلى ضوء شديد.
- المحفزات : يزداد معدل التفاعل في وجود محفز (عامل مساعد)، مثل الكادميوم ، ويعمل المحفز على تسريع كلا التفاعلين في الاتجاه الأمامي والاتجاه العكسي حيث أن مفعول العامل المساعد يخفض طاقة التنشيط. والمحفز مع ذلك لا يؤثر على التوازن الكيميائي ,و إنما ينحصر مفعوله في تسريع معدل التفاعل وبالتالي تسريع الوصول إلى حالة التوازن الكيميائي.
وعلى سبيل المثال يسرع البلاتين احتراق الهيدروجين بالأكسجين عند درجة الحرارة العادية.
- النظائر: يختلف معدل التفاعل باختلاف النظير ، ونجد ذلك على الأخص بالنسبة للهيدروجين حيث أن كتلة الديوتيريوم ضعف كتلة الهيدروجين.
- مساحة السطح : بالنسبة لتفاعلات تجري على السطح في تفاعلات مع المادة الصلبة يزداد معدل التفاعل بزيادة السطح. ذلك لزيادة عدد جزيئات المادة الصلبة المعرضة للمواد المتفاعلة الأخرى.
- التقليب : التقليب والرج يزيد من معدل التفاعل وعلى الاخص في تفاعلات المادة الصلبة مع السوائل.
تؤخذ جميع المؤثرات على معدل التفاعل في معادلة المعدل في الحسبان ، ماعدا التركيز ودرجة التفاعل (أنظر أسفله).
معادلة معدل التفاعل
{{مقالة رئيسية:معادلة المعدل}}نكتب معادلة المعدل للتفاعل الكيميائي :
n A + m B → C + D
كالآتي طبقا لتعريف الترموديناميكا الحرارية والذي يربط سرعة التفاعل بتركيز المواد الداخلة في التفاعل ، في الصيغة :

في تلك المعادلة تمثل (k(T ثابت معدل التفاعل أو "ثابت التفاعل" مع أنه ليس ثابتا حقيقيا بسبب احتوائه على عوامل كثيرة تؤثر على سرعة التفاعل ماعدا تركيز المواد ، والتي لا بد من أخذها في الحسبان ومن ضمنها كما نرى اعتماده على درجة الحرارة T. وتعتبر درجة الحرارة أهم تلك المؤثرات.
و الأسين في المعادلة n
 وm
وm يسميان درجة التفاعل وهما يعتمدان على طريقة سير التفاعل ، وتستنبط مقاديرهما عمليا من التجربة. وبالنسبة لتفاعل أولي فيتفق الأسين n
يسميان درجة التفاعل وهما يعتمدان على طريقة سير التفاعل ، وتستنبط مقاديرهما عمليا من التجربة. وبالنسبة لتفاعل أولي فيتفق الأسين n وm
وm المرفوعة لقوتهما تركيز المواد مع معاملات حساب العناصر المتفاعلة. حساب العناصر المتفاعلة ، أي عدد جزيئات كل مادة من المواد الداخلة في التفاعل لإنتاج جزيئ واحد من الناتج أو الجزيئين C و D ، بالإضافة إلى درجة التفاعل لا بد من اعتبارهما بالنسبة للتفاعل البسيط. والتفاعل البسيط هو ذلك التفاعل الذي يتم على خطوة واحدة. وتصف معادلة التفاعل التفاعل البسيط كعملية على مستوى الذرة ، أي يصتدم عدد n من الجزيئات A مع عدد m من الجزيئات B فينتج عدد من الجزيئات D.
المرفوعة لقوتهما تركيز المواد مع معاملات حساب العناصر المتفاعلة. حساب العناصر المتفاعلة ، أي عدد جزيئات كل مادة من المواد الداخلة في التفاعل لإنتاج جزيئ واحد من الناتج أو الجزيئين C و D ، بالإضافة إلى درجة التفاعل لا بد من اعتبارهما بالنسبة للتفاعل البسيط. والتفاعل البسيط هو ذلك التفاعل الذي يتم على خطوة واحدة. وتصف معادلة التفاعل التفاعل البسيط كعملية على مستوى الذرة ، أي يصتدم عدد n من الجزيئات A مع عدد m من الجزيئات B فينتج عدد من الجزيئات D.وبالنسبة لتفاعلات الغازات فيمكن الاستعاضة عن التركيز (الذي يستخدم في السوائل أو المواد الصلبة) ب الضغط اجزئي طبقا لقانون الغاز المثالي.
وبربط قانون المعدل مع توازن الكتلة للنظام المتفاعل ، فيمكن استنتاج صيغة لمعدل تغير التركيز. فإذا اعتبرنا نظام مغلق حجمه ثابت فتكون الصيغة لتغير التركيز C كالآتي:

اعتماد سرعة التفاعل على درجة الحرارة
 مقالة مفصلة: معادلة أرينيوس
مقالة مفصلة: معادلة أرينيوس
بزيادة درجة الحرارة فإن متوسط الطاقة الحركية للجسيمات (جزيئات أو أيونات أو ذرات) تزداد، فيزداد بالتالي عدد الجسيمات التي تمتلك طاقة التنشيط، فتزداد فرص التصادم، فتزداد سرعة التفاعل.
تعطي معادلة أرينيوس اعتماد معامل سرعة التفاعل k على درجة الحرارة:
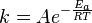
تعني Ea طاقة التنشيط:
و R ثابت الغازات العام.
ونطرا لأن درجة الحرارة T تحدد طاقة الجزيئات طبقا لتوزيع بولتزمان فيمكن القول بأن عدد التصادمات ذات طاقة أكبر من Ea تتناسب طرديا مع
 . أي أن ارتفاع درجة الحرارة تعمل علي اكتساب مجموعة أكبر من الجزيئات لطاقة قدرها Ea وبالتالي يتقترب الدالة الأسية من 1.
. أي أن ارتفاع درجة الحرارة تعمل علي اكتساب مجموعة أكبر من الجزيئات لطاقة قدرها Ea وبالتالي يتقترب الدالة الأسية من 1.ويعني A معامل الدالة الأسية ويسمى في الكيمياء معامل تردد التصادم.
وتعتمد قيم كل من A وEa على التفاعل.
اعتماد سرعة التفاعل على الضغط
يكون الاعتماد سرعة التفاعل على الضغط ضعيفا في حالة التفاعلات في السوائل وبين المواد الصلبة ، وهي تقابل أحيانا في صناعة الدواء والكيماويات :ويرتبط اعتماد ثابت معدل التفاعل على الضغط بما يسمى حجم التنشيط. ويسير التفاعل بأن تكوّن المواد المتفاعلة "مركبا وسطيا" وعادة يكون هذا المركب الوسطي في حالة إثارة. وبعدها يفقد المركب الوسطي الطاقة الزائدة ويفقد إثارته وينتج المركب الناتج من التفاعل.
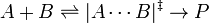
يبلغ حجم التنشيط
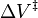 ,:
,:
حيث :
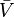 الحجم المولي الجزئي لكل من المواد المتفاعلة والناتجة من التفاعل ، d
الحجم المولي الجزئي لكل من المواد المتفاعلة والناتجة من التفاعل ، d  حالة الإثارة للمركب الوسطي.
حالة الإثارة للمركب الوسطي.وينتج أن تغير ثابت معدل التفاعل (المعتمد على المولية النسبية أو التركيز المولي) بتغير الضغط عند درجة حرارة ثابتة :

وقد يكون الحال أكثر تعقيدا حيث أن الحجم المولي الجزئي وحجم التنشيط قد يعتمدان بدورهما على الضغط.
وقد يزداد معدل التفاعل أو ينحفض بالضغط وهذا يعتمد على قيمة
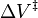 . ونعطي هنا مثالا على تاثير الضغط حيث تزيد سرعة التفاعل إلى الضعف عند تغير الضغط من الضغط الجوي (1و0 ميجا باسكال) إلى 50 ميجا باسكال لبعض تفاعلات المواد العضوية (وهذا يتميز بقيمة
. ونعطي هنا مثالا على تاثير الضغط حيث تزيد سرعة التفاعل إلى الضعف عند تغير الضغط من الضغط الجوي (1و0 ميجا باسكال) إلى 50 ميجا باسكال لبعض تفاعلات المواد العضوية (وهذا يتميز بقيمة 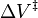 =-0.025 لتر/مول).[3]
=-0.025 لتر/مول).[3]امثلة تفاعلات
بالنسبة إلى التفاعل :
يكون معدل التفاعل :

ونلاحظ أن معدل التفاعل لا يمثل ببسلطة معاملات حساب العناصر المتفاعلة لجميع مواد التفاعل : فنجد أنه من الدرجة الأولى بالنسبة إلى H2, مع أن معامل حساب العناصر المتفاعلة 2 ، وعهو من الدرجة الثانية بالنسبة إلى NO.
وطبقا للحركة الحرارية الكيميائية chemical kinetics فهي تقسم التفاعل الكيميائي إلى عدة تفاعلات أولية بسيطة ، تنتج في نهايتها نواتج التفاعل. ولا تؤثر جميع تلك التفاعلات الأولية على سرعة التفاعل وإنما كما هو متوقع يحدد التفاعل الأولي الأكثر بطئا السرعة النهائية للتفاعل. فعلى سبيل المثال بالنسبة إلى التفاعل:
 (سريع التوازن)
(سريع التوازن) (بطيئ)
(بطيئ) (سريع)
(سريع)
نجد أن التفاعل 1 والتفاعل 3 يتميزان بسرعات تفاعل عالية بالمقارنة بسرعة التفاعل 2 ، فهو التفاعل الأقل سرعة بينهم. وبناء على ذلك فخطوته البطيئة هل التي تحدد سرعة التفاعل. وتعين درجة التفاعل سرعة التفاعل.
المصادر
[list=references][*]^ الكيمياء للصف الثالث الثانوي - الفصل الدراسي الأول - التعليم السعودي
[*]^ Kenneth Connors, Chemical Kinetics, 1990, VCH Publishers, pg. 14
[*]^ Isaacs, N.S., "Physical Organic Chemistry, 2nd edition, Section 2.8.3, Adison Wesley Longman, Harlow UK, 1995
[/list]

