معادلة أرهنيوس
(بالتحويل من معادلة أرينيوس)
معادلة أرهنيوس في الكيمياء هي معادلة سميت نسبة لصاحبها العالم الكيميائي سفانت أرهنيوس، وهي تصف المسيرة الزمنية للتفاعلات الكيميائية (حركية كيميائية). وتعطي تلك المعادلة مقادير ثابت معدل التفاعل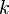 واعتماده على درجة الحرارة.
واعتماده على درجة الحرارة.
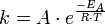
حيث :
 معامل يسمى معامل التردد (أومعامل اصتدام الجزيئات) ،
معامل يسمى معامل التردد (أومعامل اصتدام الجزيئات) ، 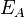 : طاقة تنشيط (بوحدة : جول·مول-1)،
: طاقة تنشيط (بوحدة : جول·مول-1)، 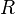 : = 8,314 J·K-1·mol-1 ثابت الغازات العام
: = 8,314 J·K-1·mol-1 ثابت الغازات العام  : درجة الحرارة (بوحدة :كلفن)،
: درجة الحرارة (بوحدة :كلفن)، 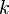 : ثابت معدل التفاعل
: ثابت معدل التفاعل
ويلاحظ أن الدالة هنا دالة أسية للأساس الطبيعي e ، وأن كلا من البسط في الأس والمقام
والمقام  لهما نفس الوحدة وهي جول/مول ، وبناءً على ذلك فالوحدات تمحو بعضها ويبقى الأس عددًا حقيقيًا ليست له وحدات (يقال عن ذلك تجانس الوحدات).
لهما نفس الوحدة وهي جول/مول ، وبناءً على ذلك فالوحدات تمحو بعضها ويبقى الأس عددًا حقيقيًا ليست له وحدات (يقال عن ذلك تجانس الوحدات).
اعتبر ارهينيوس معامل الاصتدام ثابتا ، ولكن اتضح فيما أن المعادلة تقريبية ، وأن
ثابتا ، ولكن اتضح فيما أن المعادلة تقريبية ، وأن  نفسها تعتمد على درجة الحرارة طبقا للعلاقة :
نفسها تعتمد على درجة الحرارة طبقا للعلاقة :
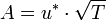
حيث u^* ثابت. ومنها نستنتج أن A تزيد مع الجزر التربيعي لدرجة الحرارة ، وتعمل بدورها هي الأخرى على تزايد سرعة التفاعل مع ارتفاع درجة الحرارة ، لكنه ارتفاعا بطيئا ، وان سرعة التفاعل تتحكم فيها درجة الحرارة بدرجة أشد من خلال الدالة الأسية.
إذن يمكننا كتابة المعادلة الأكثر دقة والتي تأخذ أيضا اعتماد المعامل A على درجة الحرارة كالآتي:
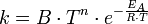
 ، وهو عدد ليست له وحدة ، كما بيّنا أعلاه.
، وهو عدد ليست له وحدة ، كما بيّنا أعلاه.

زيادة درجة الحرارة تزيد من المقام في الأس ، أي أن تقترب من الصفر بزيادة درجة الحرارة ، وتقترب الدالة الأسية من 1 ، وهو أكبر قيمة لها. بالتالي تكون k كبيرة ،أي يسير التفاعل سريعا مع ارتفاع درجة الحرارة. في نفس الوقت تتزايد k مع زيادة درجة الحرارة بالدرجة
تقترب من الصفر بزيادة درجة الحرارة ، وتقترب الدالة الأسية من 1 ، وهو أكبر قيمة لها. بالتالي تكون k كبيرة ،أي يسير التفاعل سريعا مع ارتفاع درجة الحرارة. في نفس الوقت تتزايد k مع زيادة درجة الحرارة بالدرجة 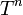 ، ولكن المؤثر الأكبر يكمن في وجود درجة الحرارة في الأس في معادلة أرهينيوس.
، ولكن المؤثر الأكبر يكمن في وجود درجة الحرارة في الأس في معادلة أرهينيوس.

حيث :
ΔG‡ طاقة جيبس الحرة للتنشيط , kB ثابت بولتزمان, h ثابت بلانك.
نجد أن ثابت معامل التفاعل عبارة عن حاصل ضرب دالة أسية للأساس e في معامل خطي يعتمد على درجة الحرارة. ولكننا لا بد وأن نتذكر أن الطاقة الحرة هي الأخرى تعتمد على درجة الحرارة. ونقوم بتعيين الطاقة الحرة للتنشيط بأنها الفرق بين شطر المعادلة يدخل فيه الإنثالبي مطروحا منه شطر متعلق بالإنتروبية مضروبة في درجة الحرارة المطلقة. وإذا قمنا بأخذ جميع تلك المتغيرات في الحسبان فإننا نعود إلى معادلة أرهينيوس التي تتكون من شطر أسي مضروبا في شطر يتغير بطيئا مع ارتفاع درجة الحرارة T.
(بالتحويل من معادلة أرينيوس)
معادلة أرهنيوس في الكيمياء هي معادلة سميت نسبة لصاحبها العالم الكيميائي سفانت أرهنيوس، وهي تصف المسيرة الزمنية للتفاعلات الكيميائية (حركية كيميائية). وتعطي تلك المعادلة مقادير ثابت معدل التفاعل
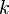 واعتماده على درجة الحرارة.
واعتماده على درجة الحرارة.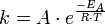
حيث :
 معامل يسمى معامل التردد (أومعامل اصتدام الجزيئات) ،
معامل يسمى معامل التردد (أومعامل اصتدام الجزيئات) ، 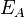 : طاقة تنشيط (بوحدة : جول·مول-1)،
: طاقة تنشيط (بوحدة : جول·مول-1)، 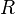 : = 8,314 J·K-1·mol-1 ثابت الغازات العام
: = 8,314 J·K-1·mol-1 ثابت الغازات العام  : درجة الحرارة (بوحدة :كلفن)،
: درجة الحرارة (بوحدة :كلفن)، 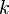 : ثابت معدل التفاعل
: ثابت معدل التفاعلويلاحظ أن الدالة هنا دالة أسية للأساس الطبيعي e ، وأن كلا من البسط في الأس
 والمقام
والمقام  لهما نفس الوحدة وهي جول/مول ، وبناءً على ذلك فالوحدات تمحو بعضها ويبقى الأس عددًا حقيقيًا ليست له وحدات (يقال عن ذلك تجانس الوحدات).
لهما نفس الوحدة وهي جول/مول ، وبناءً على ذلك فالوحدات تمحو بعضها ويبقى الأس عددًا حقيقيًا ليست له وحدات (يقال عن ذلك تجانس الوحدات).اعتبر ارهينيوس معامل الاصتدام
 ثابتا ، ولكن اتضح فيما أن المعادلة تقريبية ، وأن
ثابتا ، ولكن اتضح فيما أن المعادلة تقريبية ، وأن  نفسها تعتمد على درجة الحرارة طبقا للعلاقة :
نفسها تعتمد على درجة الحرارة طبقا للعلاقة :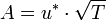
حيث u^* ثابت. ومنها نستنتج أن A تزيد مع الجزر التربيعي لدرجة الحرارة ، وتعمل بدورها هي الأخرى على تزايد سرعة التفاعل مع ارتفاع درجة الحرارة ، لكنه ارتفاعا بطيئا ، وان سرعة التفاعل تتحكم فيها درجة الحرارة بدرجة أشد من خلال الدالة الأسية.
إذن يمكننا كتابة المعادلة الأكثر دقة والتي تأخذ أيضا اعتماد المعامل A على درجة الحرارة كالآتي:
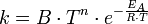
محتويات
- 1 عدد أرهينيوس
- 2 علاقة ثابت المعدل بطاقة جيبس الحرة
- 3 اقرأ أيضا
- 4 المراجع
عدد أرهينيوس
تكتب "معادلة أرهينيوس" كثيرا بالتعويض عن الأس في معادلته بعدد أرهينيوس ، وهو عدد ليست له وحدة ، كما بيّنا أعلاه.
، وهو عدد ليست له وحدة ، كما بيّنا أعلاه.
زيادة درجة الحرارة تزيد من المقام في الأس ، أي أن
 تقترب من الصفر بزيادة درجة الحرارة ، وتقترب الدالة الأسية من 1 ، وهو أكبر قيمة لها. بالتالي تكون k كبيرة ،أي يسير التفاعل سريعا مع ارتفاع درجة الحرارة. في نفس الوقت تتزايد k مع زيادة درجة الحرارة بالدرجة
تقترب من الصفر بزيادة درجة الحرارة ، وتقترب الدالة الأسية من 1 ، وهو أكبر قيمة لها. بالتالي تكون k كبيرة ،أي يسير التفاعل سريعا مع ارتفاع درجة الحرارة. في نفس الوقت تتزايد k مع زيادة درجة الحرارة بالدرجة 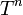 ، ولكن المؤثر الأكبر يكمن في وجود درجة الحرارة في الأس في معادلة أرهينيوس.
، ولكن المؤثر الأكبر يكمن في وجود درجة الحرارة في الأس في معادلة أرهينيوس.علاقة ثابت المعدل بطاقة جيبس الحرة
مع تقدم البحث أصبحنا الآن نكتب معادلة ارهينيوس عن سير تفاعل كيميائي مع أخذ نظرية تحول الحالة التي صاغها يوجين ويغنر وزملاؤه عام 1930. وتكتب في أغلب الأحوال على الشكل :
حيث :
ΔG‡ طاقة جيبس الحرة للتنشيط , kB ثابت بولتزمان, h ثابت بلانك.
نجد أن ثابت معامل التفاعل عبارة عن حاصل ضرب دالة أسية للأساس e في معامل خطي يعتمد على درجة الحرارة. ولكننا لا بد وأن نتذكر أن الطاقة الحرة هي الأخرى تعتمد على درجة الحرارة. ونقوم بتعيين الطاقة الحرة للتنشيط بأنها الفرق بين شطر المعادلة يدخل فيه الإنثالبي مطروحا منه شطر متعلق بالإنتروبية مضروبة في درجة الحرارة المطلقة. وإذا قمنا بأخذ جميع تلك المتغيرات في الحسبان فإننا نعود إلى معادلة أرهينيوس التي تتكون من شطر أسي مضروبا في شطر يتغير بطيئا مع ارتفاع درجة الحرارة T.

