نظرية التصادم
نظرية التصادم في الكيمياء (بالإنجليزية: Collision theory)هي نظرية ابتكرها كل من ماكس تراوتز [1] ,و وليام لويس بين عامي 1916 و 1918 وذلك لتفسير حدوث التفاعلات الكيميائية ولتفسير اختلاف سرعة التفاعلات باختلاف المواد المتفاعلة .
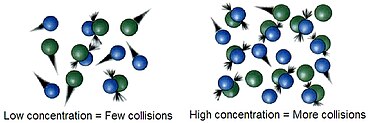
يزداد معدل التفاعل tendsبزيادة التركيز ويفسر ذلك "نظرية الاصتدام".

حركة الذرات والجزيئات في الغاز . وتعبر درجة حرارة الغاز عن متوسط طاقة حركة الذرات و الجزيئات. ملحوظة : خفضت السرعات الحقيقية لذرات الغاز في هذه الصورة نحو 1000.000.000.000 مرة
تفسر هذه النظرية حدوث التفاعل كنتيجة لاصطدام الجسيمات المتفاعلة . ولكن لا ينتج كل اصتدام إلى تفاعل وأنما عدد محدد فقط من مجمل التصادمات يملك الطاقة اللازمة لحدوث التلامس الفعال الذي يسبب تحول المتفاعلات إلى نواتج. يعود هذا الأمر إلى عدد محدد من الجزيئات يملك الطاقة اللازمة والتوجه المناسب (أو الزاوية المناسبة) أثناء التصادم من أجل كسر أي روابط موجودة وتشكيل أخرى جديدة. تدعى التصادمات الفعالة التي تؤدي إلى تشكيل النواتج بالتصادمات المثمرة.
يدعى الحد الأدنى من الطاقة اللازمة لحدوث هذا التصادم بطاقة التنشيط.
A + B → P
حيث تنتج المادة P . فتكتب معادلة سرعة التفاعل كالآتي:

وتعني هنا الأقواس القائمة أنها تعبر عن تركيز المادتين الداخلتين في التفاعل.
حيث تهتم نظرية الاصتدام بتعيين معامل سرعة التفاعل k. من أجل ذلك نحتاج لمعرفة معدل التصادم ، أي معرفة عدد التصادمات بين A و B في الثانية ولكل سنتيمتر مكعب.

وتعني σ مقطع الاصتدام ويحسب من قطري الجسيمين المصتدمين ،
و µ الكتلة المخفضة للجسيمين A و B و NA عدد أفوجادرو, الذي يعطي عدد الجزيئات في 1 مول من المادة.
وتعبر نظرية التصادم عن تغير تركيز A بالمعامل :
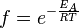
الذي يعطي احتمال أن ينتج تفاعل عن التصادم بين الجزيئين . ونجد في هذا المعامل طاقة التنشيط EA ،
و R ثابت الغازات العام T درجة الحرارة بالكلفن.
تصبح معادلة سرعة التفاعل والتي تعبر عن معدل تغير تركيز [A] مع الزمن :

وعندما نقرن بين المعادلتين نحصل على :

ويمكن تبسيط المعادلة فنحصل على معادلة أرينيوس :

وتعطينا نظرية الاصتدام نتائج دقيقة في حالة تفاعل غازين حيث تعتبر جزيئات كل غاز بأنها كرية الشكل . إلا أنها لا تصلح في حالة الجزيئات المعقدة الشكل . وتزداد عدم صلاحية تلك النظرية كلما ابتعد شكل الجزيئات عن الشكل الكروي . ولكن يمكن الاقتراب من نتائج دقيقة عن طريق إدخال "معامل للشكل " P في المعادلة :
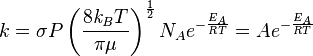
ويبلغ مقدار P أقل كثيرا من 1 لمعظم الجزيئات . ومن أجل الحصول على قيم دقيقة ل P نظريا فيجب الرجوع إلى معادلة ايرينج التي تراعي تكوّن "جزيئ وسطي " أثناء التفاعل.
[*]^ Trautz, Max. Das Gesetz der Reaktionsgeschwindigkeit und der Gleichgewichte in Gasen. Bestätigung der Additivität von Cv-3/2R. Neue Bestimmung der Integrationskonstanten und der Moleküldurchmesser, Zeitschrift für anorganische und allgemeine Chemie, Volume 96, Issue 1, Pages 1 - 28, 1916
[/list]
نظرية التصادم في الكيمياء (بالإنجليزية: Collision theory)هي نظرية ابتكرها كل من ماكس تراوتز [1] ,و وليام لويس بين عامي 1916 و 1918 وذلك لتفسير حدوث التفاعلات الكيميائية ولتفسير اختلاف سرعة التفاعلات باختلاف المواد المتفاعلة .

يزداد معدل التفاعل tendsبزيادة التركيز ويفسر ذلك "نظرية الاصتدام".

حركة الذرات والجزيئات في الغاز . وتعبر درجة حرارة الغاز عن متوسط طاقة حركة الذرات و الجزيئات. ملحوظة : خفضت السرعات الحقيقية لذرات الغاز في هذه الصورة نحو 1000.000.000.000 مرة
تفسر هذه النظرية حدوث التفاعل كنتيجة لاصطدام الجسيمات المتفاعلة . ولكن لا ينتج كل اصتدام إلى تفاعل وأنما عدد محدد فقط من مجمل التصادمات يملك الطاقة اللازمة لحدوث التلامس الفعال الذي يسبب تحول المتفاعلات إلى نواتج. يعود هذا الأمر إلى عدد محدد من الجزيئات يملك الطاقة اللازمة والتوجه المناسب (أو الزاوية المناسبة) أثناء التصادم من أجل كسر أي روابط موجودة وتشكيل أخرى جديدة. تدعى التصادمات الفعالة التي تؤدي إلى تشكيل النواتج بالتصادمات المثمرة.
يدعى الحد الأدنى من الطاقة اللازمة لحدوث هذا التصادم بطاقة التنشيط.
محتويات
- 1 الصيغة الرياضية
- 2 فروض نظرية التصادم
- 3 المراجع
- 4 اقرأ أيضا
الصيغة الرياضية
تشير الظواهر إلى أنه لكي يبدأ تفاعل لا بد وأن يحدث تصادم بين الجزيئات المتفاعلة حيث تتعدى طاقة حركة الاصتدام قدرا معينا (يمثل بتل طاقة) من الطاقة فترتبط المكونات بعضها البعض . وعلى سبيل المثال لنأحذ تفاعل بين مادتين :A + B → P
حيث تنتج المادة P . فتكتب معادلة سرعة التفاعل كالآتي:

وتعني هنا الأقواس القائمة أنها تعبر عن تركيز المادتين الداخلتين في التفاعل.
حيث تهتم نظرية الاصتدام بتعيين معامل سرعة التفاعل k. من أجل ذلك نحتاج لمعرفة معدل التصادم ، أي معرفة عدد التصادمات بين A و B في الثانية ولكل سنتيمتر مكعب.

وتعني σ مقطع الاصتدام ويحسب من قطري الجسيمين المصتدمين ،
و µ الكتلة المخفضة للجسيمين A و B و NA عدد أفوجادرو, الذي يعطي عدد الجزيئات في 1 مول من المادة.
وتعبر نظرية التصادم عن تغير تركيز A بالمعامل :
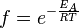
الذي يعطي احتمال أن ينتج تفاعل عن التصادم بين الجزيئين . ونجد في هذا المعامل طاقة التنشيط EA ،
و R ثابت الغازات العام T درجة الحرارة بالكلفن.
تصبح معادلة سرعة التفاعل والتي تعبر عن معدل تغير تركيز [A] مع الزمن :

وعندما نقرن بين المعادلتين نحصل على :

ويمكن تبسيط المعادلة فنحصل على معادلة أرينيوس :

وتعطينا نظرية الاصتدام نتائج دقيقة في حالة تفاعل غازين حيث تعتبر جزيئات كل غاز بأنها كرية الشكل . إلا أنها لا تصلح في حالة الجزيئات المعقدة الشكل . وتزداد عدم صلاحية تلك النظرية كلما ابتعد شكل الجزيئات عن الشكل الكروي . ولكن يمكن الاقتراب من نتائج دقيقة عن طريق إدخال "معامل للشكل " P في المعادلة :
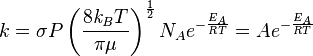
ويبلغ مقدار P أقل كثيرا من 1 لمعظم الجزيئات . ومن أجل الحصول على قيم دقيقة ل P نظريا فيجب الرجوع إلى معادلة ايرينج التي تراعي تكوّن "جزيئ وسطي " أثناء التفاعل.
فروض نظرية التصادم
- يحدث التفاعل الكيميائي كنتيجة لتصادم الجزيئات المتفاعلة مع بعضها البعض
- لا تؤدي جميع التصادمات الحادثة بين الجزيئات إلى تفاعلها كيميائيا
- الكسر من الجزيئات المنشطة والتي تملك طاقة تساوي أو تزيد من طاقة التنشيط للتفاعل تعطى بعامل ببولتزمان
- رفع درجة الحرارة يؤدي إلى هذا الكسر للجزيئات المنشطة
- يكون معدل التفاعل مساويا لعدد التصادمات المنشطة في وحدة الحجوم وفي وحدة الزمن
المراجع
[list=references][*]^ Trautz, Max. Das Gesetz der Reaktionsgeschwindigkeit und der Gleichgewichte in Gasen. Bestätigung der Additivität von Cv-3/2R. Neue Bestimmung der Integrationskonstanten und der Moleküldurchmesser, Zeitschrift für anorganische und allgemeine Chemie, Volume 96, Issue 1, Pages 1 - 28, 1916
[/list]

